全一卷
1.为了防止身体贫血,人体需要摄入的元素是
| A.Fe | B.Na | C.Ca | D.Cl |
2.下列物质的溶液能使无色酚酞试液变红的是
| A.NaCl | B.HCl | C.Ca(OH)2 | D.BaCl2 |
3.二氧化氯(ClO2)是国际上公认的最新一代广谱、高效、安全、环保的杀菌消毒剂。ClO2中Cl的化合价为
| A.+1 | B.+2 | C.+3 | D.+4 |
4.分类是一种重要的学习方法,下列物质不属于酸、碱、盐的是
| A.SO2 | B.Na2CO3 | C.H2SO4 | D.Ba(OH)2 |
5.下列实验操作正确的是
A. 稀释浓硫酸 稀释浓硫酸 | B. 排水法收集O2 排水法收集O2 |
C. 检查气密性 检查气密性 | D. 倾倒CO2 倾倒CO2 |
6.“绿水青山就是金山银山”,保护永州生态环境,人人有责,下列有关做法不正确的是
| A.工业废水应处理达标后排放 |
| B.根据作物、虫害和农药的特点按规定施用农药 |
| C.将废旧电池及时就地用土填埋 |
| D.政府要求超市、商场和集贸市场不得免费提供塑料购物袋 |
7.工业法生产硝酸的一个中间反应可用微观模型表示如下,下列说法正确的是


| A.该反应前后分子的数目无变化 | B.该反应前后元素种类没有变化 |
| C.该反应过程中氧气分子全部参与了反应 | D.该反应的化学方程式可表示为: |
8.下图是实验室制取气体的典型装置之一,能用这一装置制取气体的化学反应方程式是


A.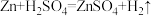 |
B. |
C. |
D. |
9.永州市创建全国禁毒示范城市,每位市民都要珍惜生命、杜绝毒品。“冰毒”是一种毒品,其主要化学成分是甲基苯丙胺(化学式为C10H15N)。下列说法不正确的是
| A.甲基苯丙胺是由碳、氢、氮三种元素组成的有机化合物 |
| B.1个甲基苯丙胺分子中含有26个原子 |
| C.甲基苯丙胺中的H、N元素的质量比为15:14 |
| D.甲基苯丙胺的相对分子质量为150 |
10.木炭或燃气在氧气不足的情况下燃烧,容易产生CO气体,下列关于CO气体的叙述不正确的是
| A.CO气体可以用作燃料 |
| B.在相对密闭的环境里,CO气体容易使人发生中毒 |
| C.将CO和O2的混合气体通入NaOH溶液中,会生成Na2CO3和H2O |
| D.高温下,CO气体可与Fe2O3等含铁氧化物反应生成Fe和CO2 |
11.为防止全球变暖,我国承诺在2060年要实现“碳中和”。减少化石燃料的使用,开发利用氢能,下图是利用太阳能制氢的示意图

(1)上图实现了能量之间的相互转化,其中电解水的过程是由电能转化为_______ (填“化学能”或“热能”)。
(2)从微观的角度讲,每2个水分子分解,会产生_______ 个氢气分子。
(3)H2与CO2在一定条件下反应,生成CH3OH(甲醇)和H2O,该反应_______ (填“属于”或“不属于”)置换反应。
(4)上图中能够循环使用的物质是_______ (填化学式)。

(1)上图实现了能量之间的相互转化,其中电解水的过程是由电能转化为
(2)从微观的角度讲,每2个水分子分解,会产生
(3)H2与CO2在一定条件下反应,生成CH3OH(甲醇)和H2O,该反应
(4)上图中能够循环使用的物质是
12.氯化钠是生产、生活中的一种重要化合物,应用很广泛。
Ⅰ.下面图甲和图乙分别是钠原子和氯原子的原子结构示意图。

(1)图甲中的x=_______ 。
(2)金属钠与氯气反应时,由图乙的结构可知,氯原子容易得到钠失去的1个电子,从而形成最外层有_______ 个电子的相对稳定的氯离子,氯离子用化学符号表示为_______ 。
Ⅱ.下表是氯化钠在不同温度下的溶解度数据。
(1)30℃时,将10g氯化钠加入到50g水中,充分搅拌后,所得到的氯化钠溶液属于_______ (填“饱和”或“不饱和”)溶液。
(2)医用盐水(溶质为NaC1)的溶质质量分数为0.9%,现有200mL该盐水(假定该溶液的密度为1g/mL),其中含NaCl的质量为_______ g。
(3)学生化学实验活动之一:配制50g质量分数为6%的氯化钠溶液,该实验需要的仪器有药匙、托盘天平、玻璃棒、胶头滴管、_______ (从下列图中选择写出名称)。

Ⅲ.工业上常用电解饱和食盐水的方法来制取氢氧化钠、氯气和氢气,其化学反应方程式可表示为: ,若w=v=1,那么x=y=z=
,若w=v=1,那么x=y=z=_______ (填数字)。
Ⅰ.下面图甲和图乙分别是钠原子和氯原子的原子结构示意图。

(1)图甲中的x=
(2)金属钠与氯气反应时,由图乙的结构可知,氯原子容易得到钠失去的1个电子,从而形成最外层有
Ⅱ.下表是氯化钠在不同温度下的溶解度数据。
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
(2)医用盐水(溶质为NaC1)的溶质质量分数为0.9%,现有200mL该盐水(假定该溶液的密度为1g/mL),其中含NaCl的质量为
(3)学生化学实验活动之一:配制50g质量分数为6%的氯化钠溶液,该实验需要的仪器有药匙、托盘天平、玻璃棒、胶头滴管、

Ⅲ.工业上常用电解饱和食盐水的方法来制取氢氧化钠、氯气和氢气,其化学反应方程式可表示为:
 ,若w=v=1,那么x=y=z=
,若w=v=1,那么x=y=z=13.某研究性学习小组对铁、铜的金属活动性及实验后的废液进行探究,设计下列实验。
Ⅰ.铁、铜金属活动性比较
结论:通过上面实验,可知Fe的金属活动性比Cu_______ (填“强”或“弱”)。
Ⅱ.将上面①、②、③实验后的液体收集在一烧杯中,对该烧杯中的废液进行分析。
(1)甲同学观察到废液呈现蓝色,认为废液中一定含有_______ (填化学式)。
(2)乙同学用玻璃棒蘸取废液滴到pH试纸上,把试纸显示的颜色与_______ 比较,测得废液pH<7,表明废液中还有硫酸。
(3)丙同学设想把废液进行回收,为了将废液中的溶质全部转化为FeSO4,采取向废液中加入过量的Fe粉,待反应完全后,过滤,滤渣的成分为_______ (填化学式)。滤液经蒸发结晶,可得到硫酸亚铁晶体。
Ⅰ.铁、铜金属活动性比较
| 实验步骤 | 实验现象及结论 |
| ①将Cu丝插入盛有2mL稀硫酸的试管中 | Cu丝无变化,没有发生化学反应 |
| ②将Fe丝插入盛有2mL稀硫酸的试管中 | Fe丝表面有气泡产生,其反应的化学方程式为 |
| ③将Fe丝插入盛有2mLCuSO4溶液的试管中 | Fe丝表面有 |
Ⅱ.将上面①、②、③实验后的液体收集在一烧杯中,对该烧杯中的废液进行分析。
(1)甲同学观察到废液呈现蓝色,认为废液中一定含有
(2)乙同学用玻璃棒蘸取废液滴到pH试纸上,把试纸显示的颜色与
(3)丙同学设想把废液进行回收,为了将废液中的溶质全部转化为FeSO4,采取向废液中加入过量的Fe粉,待反应完全后,过滤,滤渣的成分为
14.某同学做氧气的性质实验,下图为木炭在氧气中燃烧的实验示意图。

实验步骤:
①用排水法收集好一瓶氧气。②………………
③用坩埚钳夹取一小块木炭,在酒精灯上加热到发红,插入到盛满氧气的集气瓶中,燃烧停止后,取出坩埚钳。
④向集气瓶中加入少量澄清石灰水,振荡。
根据实验操作,通过分析,回答下列问题:
(1)步骤②具体操作为_______ 。
(2)步骤③操作中,最好是将烧红的木炭由瓶口缓慢插入到盛满氧气的集气瓶中,这一实验操作的主要目的是_______ 。
(3)步骤④操作中,可观察到澄清石灰水变浑浊,其发生反应的化学方程式为_______ 。
(4)酒精(化学式C2H5OH)和木炭都是常用的燃料,若取相同质量的C2H5OH和C在氧气中完全燃烧,两者中消耗O2的质量较少的是_______ (填“C2H5OH”或“C”)。

实验步骤:
①用排水法收集好一瓶氧气。②………………
③用坩埚钳夹取一小块木炭,在酒精灯上加热到发红,插入到盛满氧气的集气瓶中,燃烧停止后,取出坩埚钳。
④向集气瓶中加入少量澄清石灰水,振荡。
根据实验操作,通过分析,回答下列问题:
(1)步骤②具体操作为
(2)步骤③操作中,最好是将烧红的木炭由瓶口缓慢插入到盛满氧气的集气瓶中,这一实验操作的主要目的是
(3)步骤④操作中,可观察到澄清石灰水变浑浊,其发生反应的化学方程式为
(4)酒精(化学式C2H5OH)和木炭都是常用的燃料,若取相同质量的C2H5OH和C在氧气中完全燃烧,两者中消耗O2的质量较少的是
15.取溶质质量分数为5%的过氧化氢溶液60.0g于锥形瓶中,加入一定量的二氧化锰,反应完全(假定过氧化氢全部分解,产生的氧气全部逸出,水的蒸发忽略不计)。
请分析并计算:
(1)上述过氧化氢溶液完全反应后,产生氧气的质量是多少?(写出详细的计算过程,保留小数点后一位)
(2)若测得上述反应后锥形瓶内物质的质量为59.8g,根据二氧化锰在该反应中所起的作用,可知加入二氧化锰的质量应为 g。
请分析并计算:
(1)上述过氧化氢溶液完全反应后,产生氧气的质量是多少?(写出详细的计算过程,保留小数点后一位)
(2)若测得上述反应后锥形瓶内物质的质量为59.8g,根据二氧化锰在该反应中所起的作用,可知加入二氧化锰的质量应为 g。
 搜索
搜索
 难度系数:0.85
难度系数:0.85  答案解析
答案解析
 有奖纠错
有奖纠错
