全一卷
1.下列工业制法的原理主要属于物理变化的是
| A.工业炼铁 | B.工业制二氧化碳 |
| C.工业制氧气 | D.工业制纯碱 |
2.下列实验操作不正确的是
A.倾倒液体药品 | B.过滤 |
C.稀释浓硫酸 | D.取少量固体药品 |
3.2020年国家“十四五”规划中提出逐步实现“碳达峰”、“碳中和”,实施“低碳生活、高质量发展”,下列做法符合这一主题的是
| A.节假日燃放烟花爆竹增加节日气氛 |
| B.大力开发太阳能、风能、核能、氢能等新能源 |
| C.燃烧衣作物秸秆以增加土地肥效 |
| D.为满足社会用电需求,大力发展燃煤火力发电 |
4.下列关于氧气的说法正确的是
| A.鱼类能在水中生存,说明氧气易溶于水 |
| B.硫在氧气中燃烧放热,产生微弱的淡蓝色火焰 |
| C.氧气能支持燃烧,可用作火箭燃料 |
| D.空气中的氧气主要来自于植物的光合作用 |
5.下列关于化肥与农药的说法正确的是
| A.氯化铵可与碱性草木灰混合使用,提高肥效 |
| B.磷酸二氢铵、硫酸钾和尿素依次属于复合肥料、钾肥、氮肥 |
| C.农药本身有毒性,应该禁止使用 |
| D.硝酸铵受潮结块后,要用锤子砸碎后使用 |
6.下列关于碳及其氧化物的说法正确的是
| A.金刚石、石墨和C60的性质相似 |
| B.CO2可以使干石蕊纸花变红 |
| C.CO2灭火既利用了CO2的物理性质,又利用了其化学性质 |
| D.CO与CuO反应,利用了CO的氧化性 |
7.截止2021年6月,全球感染新冠病毒的人数近18亿,做好个人防护尤为重要。过氧乙酸(C2H4O3)是一种常用的消毒剂,下列关于过氧乙酸的说法正确的是
| A.过氧乙酸属于氧化物 |
| B.过氧乙酸中碳、氧元素的质量比为2:3 |
| C.过氧乙酸是由2个碳原子、4个氢原子和3个氧原子构成 |
| D.过氧乙酸中氢元素质量分数最小 |
8.下列有关推理正确的是
| A.过滤和蒸馏是常用的净水方法,均可以使硬水变为软水净水, |
| B.O2和CO2的组成中都含有氧元素,构成它们的微粒中都有氧分子 |
| C.混合物是由不同物质组成的,同一种元素不可能组成混合物 |
| D.pH>7的溶液呈碱性,则碱性溶液的pH一定大于7 |
9.下列各组离子在溶液中能大量共存,并形成无色溶液的是
A.Na+ Ca2+ Cl- Cl- |
B.Ag+ H+ Cl- |
C. K+ OH- K+ OH-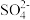 |
D.Na+ Fe3+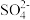 Cl- Cl- |
10.某反应的微观示意图如图所示,下列有关说法正确的是
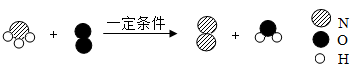

| A.该变化过程中的最小微粒是分子 |
| B.该变化过程中氮元素的化合价由+3价变为0价 |
| C.该反应属于置换反应 |
| D.该反应中反应物的质量比为4:3 |
11.下列实验方案不能达到实验目的的是
| 序号 | 实验目的 | 实验方案 |
| A | 除去NaCl溶液中少量的CaCl2 | 加入适量的Na2CO3溶液后过滤 |
| B | 除去氨气中的水蒸气 | 将气体通过浓硫酸 |
| C | 鉴别酒精、生理盐水和白醋 | 闻气味 |
| D | 鉴别棉制品和羊毛制品 | 灼烧闻气味 |
| A.A | B.B | C.C | D.D |
12.将锌粉和铁粉的混合物加入盛有一 定量硝酸银溶液的烧杯中,充分反应后过滤,关于滤渣和滤液的说法正确的是
| A.若向滤渣中加稀盐酸,有气泡产生,则滤液中最少有2种溶质 |
| B.若向滤液中加稀盐酸,无明显现象,则法渣中最多有1种金属 |
| C.若滤渣中只有两种金属,则滤液中最少有1种溶质 |
| D.若滤液中只有两种溶质,则滤渣中最多有1种金属 |
13.用化学符号填空。
(1)五个磷原子___________ ;
(2)三个氧原子构成的分子___________ ;
(3) 表示的是
表示的是___________ ;
(4)+5价氮的氧化物___________ 。
(1)五个磷原子
(2)三个氧原子构成的分子
(3)
 表示的是
表示的是(4)+5价氮的氧化物
14.化学与生活、环境,能源、材料等密切相关。
(1)“垃圾分类,人人有责”。下列可回收垃圾的主要成分是有机合成材料的是___________ (填序号);
A 废弃纸箱 B 塑科瓶 C 铝质易拉罐
(2)人们常用“84"消毒液对各场所进行消毒,它的有效成分是次氯酸钠(NaClO),分析次氯酸钠的构成,写出次氯酸的化学式___________ ;
(3)在汽油中加入适量乙醇(C2H5OH)作为汽车燃料,可适当节省石油资源。请写出乙醇充分燃烧的化学方程式:___________ ;
(4)2021年从三星地出土了大量表面有一层“绿色物质”的青铜器,研究人员将“绿色物质”隔绝空气加热,发现它分解生成氧化铜、水和二氧化碳,由此得出组成“绿色物质”的元素有___________ (填元素符号)。
(1)“垃圾分类,人人有责”。下列可回收垃圾的主要成分是有机合成材料的是
A 废弃纸箱 B 塑科瓶 C 铝质易拉罐
(2)人们常用“84"消毒液对各场所进行消毒,它的有效成分是次氯酸钠(NaClO),分析次氯酸钠的构成,写出次氯酸的化学式
(3)在汽油中加入适量乙醇(C2H5OH)作为汽车燃料,可适当节省石油资源。请写出乙醇充分燃烧的化学方程式:
(4)2021年从三星地出土了大量表面有一层“绿色物质”的青铜器,研究人员将“绿色物质”隔绝空气加热,发现它分解生成氧化铜、水和二氧化碳,由此得出组成“绿色物质”的元素有
15.根据下列粒子结构示意图和部分元素周期表信息回答问题:

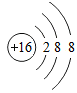
(1)图1中A是镓元素的原子结构示意图,其中x的值为___________ ;
(2)图1中B是某元素的原子结构示意图。标出该元素在图2中的位置:___________ (填序号);
(3)镓元素广泛应用于第三代半导体材料中,它的化学性质与图2中(填序号)___________ 位置的元素相似。

(1)图1中A是镓元素的原子结构示意图,其中x的值为
(2)图1中B是某元素的原子结构示意图。标出该元素在图2中的位置:
(3)镓元素广泛应用于第三代半导体材料中,它的化学性质与图2中(填序号)
16.K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下:
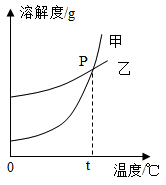
(1)图中能表示K2CO3溶解曲线的是___________ (填“甲”或“乙”);
(2)在20℃时,将20g的KNO3加入到50g的水中,充分搅拌,得到溶液的质量为___________ ;
(3)在t℃时,K2CO3饱和溶液的溶质质量分数(w1)和KNO3饱和溶液的溶质质量分数(w2)的大小关系:w1___________ w2(填“>”、“=”或“<”);
(4)在不改变溶液质量的情况下,要使一定量接近饱和的KNO3溶液变为饱和容液的方法是:___________ 。
| 温度/℃ | 20 | 30 | 50 | 60 | 80 | |
| 溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |

(1)图中能表示K2CO3溶解曲线的是
(2)在20℃时,将20g的KNO3加入到50g的水中,充分搅拌,得到溶液的质量为
(3)在t℃时,K2CO3饱和溶液的溶质质量分数(w1)和KNO3饱和溶液的溶质质量分数(w2)的大小关系:w1
(4)在不改变溶液质量的情况下,要使一定量接近饱和的KNO3溶液变为饱和容液的方法是:
17.A-F为初中化学中常见的六种物质。其中E是一种碱,它广泛应用于制取肥皂,以及石油、造纸、纺织和印染等工业。它们之间的转化是初中常见的化学反应,转化关系如图所示(“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去)。请回答下列问题:
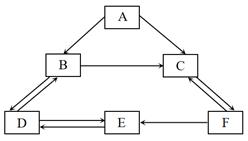
(1)E的化学式:___________ ;
(2)C→F的反应属于___________ 反应(填基本反应类型);
(3)写出F→E的化学方程式:___________ ;
(4)A不可能的物质类别是:___________ (填“单质”、“氧化物”、“酸”“碱”,“盐”中的一种)。

(1)E的化学式:
(2)C→F的反应属于
(3)写出F→E的化学方程式:
(4)A不可能的物质类别是:
18.根据如图装置,结合所学化学知识回答问题。

(1)写出图中仪器①的名称___________ 。
(2)实验室制取氧气的方法有多种方法,从“低碳”角度分析,最佳方法是(用化学方程式表示)___________ 。若用C装置收集氧气,验满的方法为:___________ 。
(3)在实验室室可以用如热固体无水醋酸钠和固体碱石灰的方法制取甲烷。通常情况下,甲烷的密度比空气小,难溶于水,实验室制取甲烷选择的发生装置是___________ (填字母)。若用F装置收集甲烷,气体应从___________ 端通入(填“a”或“b”)。

(1)写出图中仪器①的名称
(2)实验室制取氧气的方法有多种方法,从“低碳”角度分析,最佳方法是(用化学方程式表示)
(3)在实验室室可以用如热固体无水醋酸钠和固体碱石灰的方法制取甲烷。通常情况下,甲烷的密度比空气小,难溶于水,实验室制取甲烷选择的发生装置是
19.十堰某中学化学兴趣小组为鉴定某工厂排出的无色污水成分,他们查阅工厂的有关资料,推测出污水中可能含有盐酸、硫酸钠和氢氧化钠中的一种或几种物质,小组同学取污水进行了探究:
(查阅资料)碳酸钠溶液呈中性
(实验探究)
实验一:小组同学用pH试纸测得的污水的pH=2,由此得出污水中一定不含___________ ,原理是:___________ (用化学方程式表示)。
实验二:为检测污水中可能含有的成分,甲同学做了如下实验:
实验二中生成白色沉淀的化学方程式为___________ 。
(得出结论)兴趣小组确定了废水的成分
(反思与评价)乙同学经过思考后,用物理方法也得到了甲同学的实验结论,他的实验操作及实验现象是:___________ 。
(查阅资料)碳酸钠溶液呈中性
(实验探究)
实验一:小组同学用pH试纸测得的污水的pH=2,由此得出污水中一定不含
实验二:为检测污水中可能含有的成分,甲同学做了如下实验:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量污水于一支洁净试管中,向其中滴加少量的 | 有白色沉淀生成 | 污水中一定含有硫酸钠 |
(得出结论)兴趣小组确定了废水的成分
(反思与评价)乙同学经过思考后,用物理方法也得到了甲同学的实验结论,他的实验操作及实验现象是:
20.将适量的二氧化碳通入到一定质量的氢氧化钠的溶液中,恰好完全反应,得到106g质量分数为10%的碳酸钠溶液。
(1)反应生成的碳酸钠质量为 g。
(2)反应前氢氧化钠溶液的溶质质量分数。(写出计算过程,最终结果保留0.1%)
(1)反应生成的碳酸钠质量为 g。
(2)反应前氢氧化钠溶液的溶质质量分数。(写出计算过程,最终结果保留0.1%)
 搜索
搜索
 难度系数:0.65
难度系数:0.65  答案解析
答案解析
 有奖纠错
有奖纠错
