全一卷
1.随着新冠疫情的迅速爆发,人类越来越认识到自然环境的重要性、习总书记指出,人类与自然是生命的共同体,人类的生存离不开自然环境。下列叙述错误的是
| A.在工业生产中,采用低碳技术,降低能耗,能体现“绿色发展”的理念 |
| B.新冠疫情期间,人们可以用食醋杀死新冠病毒 |
| C.开发使用可降解塑料,能有效解决“白色污染”问题 |
| D.使用无铅汽油可以减少汽车尾气污染 |
2.下列图示实验操作正确的是
A.点燃镁条 | B.称量氧化钠 |
C.加入锌粒 | D.过滤 |
3.下列叙述属于化学变化的是
| A.浓硫酸稀释 | B.水力发电 | C.食物的腐烂 | D.碘的升华 |
4.下列表述完全正确的是
| A.钛合金与人体“相容性”好,可用于制造人造骨 |
| B.质子数相同的粒子,一定是同种元素的原子 |
| C.稀有气体化学性质比较稳定,它们的原子最外层都有8个电子 |
| D.有一瓶未知体积的NaCl溶液,若使用量筒测量其体积,仰视读数会导致测量结果偏大 |
5.分类法是学习化学的重要方法之一,某同学对所学的部分化学物质进行分类。其中完全正确的是
| 类别 选项 | 单质 | 氧化物 | 碱 | 盐 | 混合物 |
| A | C60 | 冰 | 纯碱 | KNO3 | 盐酸 |
| B | Mg | SO2 | 烧碱 | 胆矾 | AgNO3 |
| C | O2 | H2O | 熟石灰 | MgSO4 | 白磷和红磷 |
| D | 青铜 | P2O5 | Ba(OH)2 | NaCl | 波尔多液 |
| A.A | B.B | C.C | D.D |
6.下列化学方程式与事实相符且正确的是
A.乙醇在空气中完全燃烧: |
B.铝土矿溶于盐酸: |
C.将洁净的铁丝浸入硫酸铜溶液中: |
D.孔雀石溶于稀盐酸: |
7.下列除杂所用试剂和主要实验操作均正确的是
| 类别 选项 | 物质(括号内为杂质) | 所用试剂 | 主要实验操作 |
| A | KNO3(K2CO3) | 适量盐酸 | 蒸发,结晶 |
| B | 铜粉(锌粉) | 过量稀硫酸 | 过滤,洗涤,干操 |
| C | MnO2粉末(碳粉) | 水 | 过滤,蒸发 |
| D | FeC12溶液(CuC12) | 过量铁粉 | 结晶 |
| A.A | B.B | C.C | D.D |
8.下图所示的图像能正确反映对应变化关系的是


| A.①向Ca(OH)2溶液通入CO2至过量 |
| B.②向等质量、质量分数的一份稀盐酸中分别加入不同的金属 |
| C.③向一定量10%的盐酸中逐滴加入NaOH溶液 |
| D.④20°C时,向一定质量分数的NaCl溶液中加入KNO3固体 |
9.a、b、c三种固体物质的溶解度曲线如图所示。下列说法正确的是


| A.t1℃时,a物质的溶解度是30g |
| B.t1℃时,b的饱和溶液中溶质的质量分数为50% |
| C.t3℃时,各取15ga、b、c三种物质分别加入到50g水中充分溶解,能得到饱和溶液的是c |
| D.t2℃和t3℃时的两份b溶液,所含溶质的质量不可能相等 |
10.某化肥厂以煤、空气、水为原料合成氨,生产流程如图所示。下列说法错误的是


| A.氨气转变为液氨是放热过程 |
B.设备1中此反应 一定发生 一定发生 |
| C.设备2中发生的反应,属于基本反应类型中的化合反应 |
| D.设备3中参加反应的N2和H2的质量比为14:1 |
11.(1)墙内开花墙外香,说明______ 在不停地运动。
(2)画出钾离子的结构示意图:______ 。
(3)“冰毒”的化学式是C10H15N,其中碳、氢元素的质量比为______ 。
(4)羊毛、蚕丝的主要成分都是______ 。(填“蛋白质”或“纤维素”)
(5)过磷酸钙是Ca(H2PO4)2和______ 的混合物。(填化学式)
(6)我们需要清新洁净的空气,为减少雾霾的吸入,人们出行经常戴口罩,是利用口罩中填充物(活性炭)的______ 性。
(2)画出钾离子的结构示意图:
(3)“冰毒”的化学式是C10H15N,其中碳、氢元素的质量比为
(4)羊毛、蚕丝的主要成分都是
(5)过磷酸钙是Ca(H2PO4)2和
(6)我们需要清新洁净的空气,为减少雾霾的吸入,人们出行经常戴口罩,是利用口罩中填充物(活性炭)的
12.1、建立“宏观·微观”之间的联系,是化学学习的重要方法。根据图示回答下列问题:


(1)硒元素被科学家称为“抗癌之王"”,科学界研究发现血硒水平的高低与癌的发生息息相关。图一是硒元素的相关信息:硒原子在化学变化中易______ 电子(填“得到”或“失去”)。硒元素的相对原子质量是______ 。
(2)由图二可知:在元素周期表中,钠、镁、铝元素位于同一周期,是因为它们具有相同的______ 。
(3)科学家发现,利用催化剂可有效消除室内装修材料释放的有害气体甲醛(HCHO)。请根据图三写出反应的化学方程式______ 。
Ⅱ、人们在实验研究中总结出常见金属的活动性顺序:

(4)请在表中 内填写对应的元素符号
内填写对应的元素符号______ 。
(5)Mg、Sn、Pb、Cu、Ag五种金属,能与稀盐酸(或稀硫酸)发生置换反应的金属有______ 种。


(1)硒元素被科学家称为“抗癌之王"”,科学界研究发现血硒水平的高低与癌的发生息息相关。图一是硒元素的相关信息:硒原子在化学变化中易
(2)由图二可知:在元素周期表中,钠、镁、铝元素位于同一周期,是因为它们具有相同的
(3)科学家发现,利用催化剂可有效消除室内装修材料释放的有害气体甲醛(HCHO)。请根据图三写出反应的化学方程式
Ⅱ、人们在实验研究中总结出常见金属的活动性顺序:

(4)请在表中
 内填写对应的元素符号
内填写对应的元素符号(5)Mg、Sn、Pb、Cu、Ag五种金属,能与稀盐酸(或稀硫酸)发生置换反应的金属有
13.根据下列装置,回答问题:


(1)写出图中标号①仪器的名称:______ 。
(2)实验室里常用H2O2和MnO2来制取O2,应选用的发生装置为图中的______ 。(填字母)
(3)实验室若用装置D收集H2,则气体应从导管______ (填“a”或“b”)端进入。
(4)工业常需分离H2、CO2的混合气体。某同学采用装置E也能达到分离该混合气体的目的。操作步如下:
步骤1:关闭活塞B,打开活塞A,通入混合气体,可收集到______ 。
步骤2;然后,______ (填操作),又可收集到另一种气体。


(1)写出图中标号①仪器的名称:
(2)实验室里常用H2O2和MnO2来制取O2,应选用的发生装置为图中的
(3)实验室若用装置D收集H2,则气体应从导管
(4)工业常需分离H2、CO2的混合气体。某同学采用装置E也能达到分离该混合气体的目的。操作步如下:
步骤1:关闭活塞B,打开活塞A,通入混合气体,可收集到
步骤2;然后,
14.某兴趣小组的同学们利用如图所示的装置对CO还原Fe2O3粉末的实验进行探究(固定装置略)。

【查阅资料】CO能溶于铜液【醋酸二氨合铜(Ⅰ)和氨水的混合液】
(1)按上图连接装置A-E,在装入试剂前,先______ 。
(2)写出装置B中反应的化学方程式______ 。
(3)通入CO2一段时间后,先点燃______ 处酒精喷灯(填“A”或“D”)。
(4)装置C中玻璃管的作用:______ 。
(5)反应一段时间后,能证明CO与Fe2O3反应的实验现象:______ ;______ 。写出装置D中反应的化学方程式______ 。
(6)某同学认为该装置有缺陷,需在装置E后再连接装置F,其目的是______ 。装置E.F的接口连接顺序:a连接______ (填“b”或“c”)。

【查阅资料】CO能溶于铜液【醋酸二氨合铜(Ⅰ)和氨水的混合液】
(1)按上图连接装置A-E,在装入试剂前,先
(2)写出装置B中反应的化学方程式
(3)通入CO2一段时间后,先点燃
(4)装置C中玻璃管的作用:
(5)反应一段时间后,能证明CO与Fe2O3反应的实验现象:
(6)某同学认为该装置有缺陷,需在装置E后再连接装置F,其目的是
15.氯化亚铜CuCl是一种难溶于水和乙醇且在潮湿空气中易变质的物质,广泛应用于冶金、电镀、医药等行业、CuCl的制备流程如下:

(1)“操作Y”名称是______ 。
(2)CuCl中铜元素的化合价为______ 。
(3)请配平“反应Ⅱ”的化学方程式:______ 
______ 
______ 
______ 
______ 
______ 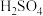 。
。
(4)在“滤液Ⅱ”中可以循环利用的物质(水除外)是______ 。(填化学式)
(5)“醇洗”的目的是______ ,防止后续过程中氯化亚铜变质。

(1)“操作Y”名称是
(2)CuCl中铜元素的化合价为
(3)请配平“反应Ⅱ”的化学方程式:





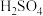 。
。(4)在“滤液Ⅱ”中可以循环利用的物质(水除外)是
(5)“醇洗”的目的是
16.图中的物质均为初中化学常见的物质。其中甲、乙、丙、丁、戊均为单质,丙是一种黄绿色有毒气体,是由17号元素组成的双原子分子,丁是黑色固体,戊是紫红色金属;常温下A是液态,农业上常用F改良酸性土壤(图中部分反应条件已省略)回答下列问题:

(1)甲为______ ;B为______ 。(填化学式)
(2)在电解A实验中,与电源______ 极相连的一端产生物质乙。
(3)工业上常用丙和F制漂白粉(CaCl2和Ca(C1O)2)。同时生成A.请写出该反应的化学方程式______ 。
(4)D和A反应______ 热量。(填“吸收”或“放出”)

(1)甲为
(2)在电解A实验中,与电源
(3)工业上常用丙和F制漂白粉(CaCl2和Ca(C1O)2)。同时生成A.请写出该反应的化学方程式
(4)D和A反应
17.已知Mg能在CO2中燃烧,根据金属活动性顺序表,Na的金属活动性比Mg强,说明Na也能在CO2中燃烧。为了验证,实验小组进行了以下实验探究:
【查阅资料】
①金属钠性质活泼,常温下,金属钠极易与氧气反应,生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠。金属钠还可以与水剧烈反应,放出氢气。
②Na2CO3溶液显碱性;CaCl2溶液显中性。

【实验探究一】
步骤1:打开活塞,让A装置中产生的气体依次通过B、C,收集一瓶纯净的CO2气体。
步骤2:将燃烧的钠迅速伸入集气瓶中,观察到钠在CO2中继续燃烧,发光放热,冷却后观察到瓶内附着黑色颗粒,并粘附着白色物质。
【问题讨论】
(1)为获得纯净的CO2,可利用装置B除去CO2中混有的______ ;装置C中盛放的试剂是______ 。
(2)步骤2中生成的黑色固体成分是______ 。
【初步结论】Na能在CO2中燃烧。
【提出问题】白色物质是什么?
【猜想与假设】猜想一:氧化钠 猜想二:碳酸钠;
猜想三:氧化钠和碳酸钠的混合物; 猜想四:氢氧化钠。
(3)大家讨论后一致认为猜想四是错误的,理由是______ 。
【实验探究二】对白色物质是什么进行实验探究,方案设计如下:
方案1:取该样品少量于试管中,加入适量的水。振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色。结论:白色物质中一定有氧化钠。
方案2:取该样品少量于试管中,滴加足量盐酸,溶液中有气泡冒出:
结论:白色物质中一定有______ 。
方案3:取该样品少量于试管中,加入适量的水,振荡,过滤,向滤液中加入过量的氯化钙溶液,出现白色沉淀,过滤,再向滤液中滴加无色酚酞溶液,无明显现象。
【反思与评价】
(4)甲同学思考后提出方案1得出的结论不正确,其理由是______ 。
(5)请将方案2结论补充完整:______ 。(填化学式)
(6)方案3中加入过量CaCl2溶液的目的是______ 。写出此反应的化学方程式______ 。
【实验结论】
(7)综上所述,你认为猜想______ 成立。
(8)请写出Na在CO2中燃烧的化学方程式______ 。
【查阅资料】
①金属钠性质活泼,常温下,金属钠极易与氧气反应,生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠。金属钠还可以与水剧烈反应,放出氢气。
②Na2CO3溶液显碱性;CaCl2溶液显中性。

【实验探究一】
步骤1:打开活塞,让A装置中产生的气体依次通过B、C,收集一瓶纯净的CO2气体。
步骤2:将燃烧的钠迅速伸入集气瓶中,观察到钠在CO2中继续燃烧,发光放热,冷却后观察到瓶内附着黑色颗粒,并粘附着白色物质。
【问题讨论】
(1)为获得纯净的CO2,可利用装置B除去CO2中混有的
(2)步骤2中生成的黑色固体成分是
【初步结论】Na能在CO2中燃烧。
【提出问题】白色物质是什么?
【猜想与假设】猜想一:氧化钠 猜想二:碳酸钠;
猜想三:氧化钠和碳酸钠的混合物; 猜想四:氢氧化钠。
(3)大家讨论后一致认为猜想四是错误的,理由是
【实验探究二】对白色物质是什么进行实验探究,方案设计如下:
方案1:取该样品少量于试管中,加入适量的水。振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色。结论:白色物质中一定有氧化钠。
方案2:取该样品少量于试管中,滴加足量盐酸,溶液中有气泡冒出:
结论:白色物质中一定有
方案3:取该样品少量于试管中,加入适量的水,振荡,过滤,向滤液中加入过量的氯化钙溶液,出现白色沉淀,过滤,再向滤液中滴加无色酚酞溶液,无明显现象。
【反思与评价】
(4)甲同学思考后提出方案1得出的结论不正确,其理由是
(5)请将方案2结论补充完整:
(6)方案3中加入过量CaCl2溶液的目的是
【实验结论】
(7)综上所述,你认为猜想
(8)请写出Na在CO2中燃烧的化学方程式
18.将50.0g盐酸、氯化镁和氯化铝的混合溶液置于烧杯中,逐滴加入质量分数为20.0%的氢氧化钠溶液,生成氢氧化铝沉淀的最大质量为7.8g。加入氢氧化钠溶液质量和生成沉淀质量的关系如图所示。请根据题意回答问题:

已知:
(1)B点溶液中所含溶质是______(填化学式)。
(2)求图中A点的坐标:______。
(3)原混合溶液中MgCl2的质量分数是多少?(写出计算过程,计算结果精确到0.1%)

已知:

(1)B点溶液中所含溶质是______(填化学式)。
(2)求图中A点的坐标:______。
(3)原混合溶液中MgCl2的质量分数是多少?(写出计算过程,计算结果精确到0.1%)
 搜索
搜索
 难度系数:0.85
难度系数:0.85  答案解析
答案解析
 有奖纠错
有奖纠错
