全一卷
1.下列变化中属于化学变化的是( )
| A.汽油挥发 | B.海水晒盐 | C.石蜡熔化 | D.高粱酿酒 |
2.下列各项警示标示与存放的物质不相符合的是( )
A. 甲醛 甲醛 | B. 酒精 酒精 |
C. 烧碱 烧碱 | D. 浓硫酸 浓硫酸 |
3.下列化学实验操作正确的是( )
A.振荡试管 | B.取固体药品 |
C.移走蒸发器 | D.量筒读数 |
4.在太空舱里常用NiFe2O4作催化剂将宇航员呼出的CO2转化为O2。已知NiFe2O4中Fe元素为+3价,则Ni元素的化合价为
| A.+1价 | B.+2价 | C.+3价 | D.+4价 |
5.下列符号中的“2”与O2中的“2”所表示的含义相似的是( )
| A.H2O | B.2Zn | C.2CO | D.SO42- |
6.下列关于水的说法正确的是( )
| A.用肥皂水不能区别硬水和软水 |
| B.蒸馏后得到的水是纯净物 |
| C.生活污水可以随意排放 |
| D.在河水样品中加入明矾可以除去水中所有杂质 |
7.下列有关环境和能源的说法错误的是( )
| A.天然气是比较清洁的化石燃料 |
| B.酸雨对农作物、桥梁、建筑物等有破坏作用 |
| C.由于新能源开发,可以无节制地使用石油资源 |
| D.生活中常用的汽油、煤油、柴油都是石油产品 |
8.根据物质的性质与用途,下列对应关系不正确的是( )
| A.盐酸具有酸性——除铁锈 |
| B.铁粉可与氧气和水反应——食品保鲜剂 |
| C.活性炭具有吸附性——冰箱除臭剂 |
| D.CO具有可燃性——冶炼金属 |
9.X、Y、Z三种物质的溶解度曲线如图所示,下列说法正确的是( )
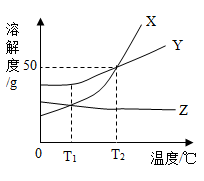

| A.Y的溶解度为50 g |
| B.T2℃时,X、Y两种物质的溶解度相等 |
| C.T1℃时,三种物质的溶解度由大到小的顺序是Y>X>Z |
| D.T2℃时,50 g H2O与50 g X混合,可得到100 g X的饱和溶液 |
10.下列实验操作不能达到实验目的的是(括号内为杂质)( )
| 选项 | 物质 | 目的 | 主要实验操作 |
| A | NH4Cl和尿素 | 鉴别 | 取样,加入熟石灰粉末、研磨、闻气味 |
| B | NaNO3和Na2SO4固体 | 鉴别 | 取样,加水溶解,滴加BaCl2溶液,观察是否有白色沉淀 |
| C | Na2CO3(NaHCO3) | 除杂 | 加稀盐酸,蒸发结晶 |
| D | K2SO4溶液(KOH) | 除杂 | 滴加稀硫酸至pH等于7 |
| A.A | B.B | C.C | D.D |
11.抗击“新型冠状病毒肺炎”疫情是一项长期的工作,我们要采取有效防疫措施,免受病毒侵害。
(1)我们每天要补充蛋白质提高自身免疫力。下列食物富含蛋白质的是_________ (填字母序号)。
a.鸡蛋 b.米饭 c.白菜 d.西瓜
(2)用医用酒精进行室内消毒时,若不慎引起小面积失火,可用湿布扑灭。其灭火主要原理是__________ 。
(3)医用口罩的中间层是聚丙烯熔喷布,起过滤病毒作用。聚丙烯属于_________ (填“有机合成”或“复合”)材料。生产出的外科医用口罩需用环氧乙烷进行灭菌,环氧乙烷的化学式为C2H4O,该物质中含有_______ 种元素,其组成元素的质量比为_______________ 。
(1)我们每天要补充蛋白质提高自身免疫力。下列食物富含蛋白质的是
a.鸡蛋 b.米饭 c.白菜 d.西瓜
(2)用医用酒精进行室内消毒时,若不慎引起小面积失火,可用湿布扑灭。其灭火主要原理是
(3)医用口罩的中间层是聚丙烯熔喷布,起过滤病毒作用。聚丙烯属于
12.酸、碱、盐的溶解性表是学习化学的重要工具之一。下表是部分酸、碱、盐在水中的溶解性(20。C),请回答下列问题。
(1)上述阴、阳离子形成不溶性碱的化学式为________ , 形成复合肥料的化学式为_____ 。
(2)KOH溶液和Ba(NO3)2溶液_______ (填“能“或“不能“)反应,理由是_______ 。
(3)下列各组离子在水溶液中能大量共存的是_______________ 。
A. OH-H+Ba2+NO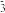 B. OH-Ba2+K+Cl-
B. OH-Ba2+K+Cl-
C. CO K+Ba2+Cl-D. CO
K+Ba2+Cl-D. CO Cu2+NO
Cu2+NO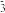 K+
K+
| 阴离子 阳离子 | OH- | NO3- | CO32- | Cl- |
| K+ | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 不 | 溶 |
| Cu2+ | 不 | 溶 | 不 | 溶 |
(1)上述阴、阳离子形成不溶性碱的化学式为
(2)KOH溶液和Ba(NO3)2溶液
(3)下列各组离子在水溶液中能大量共存的是
A. OH-H+Ba2+NO
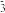 B. OH-Ba2+K+Cl-
B. OH-Ba2+K+Cl-C. CO
 K+Ba2+Cl-D. CO
K+Ba2+Cl-D. CO Cu2+NO
Cu2+NO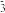 K+
K+13.化学的学科特征让在原子、分子的水平上研究物成和创造物质。请从微观的角度回答下列问题。
(1)物质的结构决定性质。
①根据Na、Al的原子结构示意图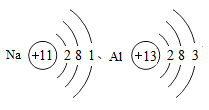 可推知,金属Na、Al的化学性质不同的原因是
可推知,金属Na、Al的化学性质不同的原因是
②CO和CO2化学性质不同的原因是_______________ .
③稀盐酸和稀硫酸都可使紫色石蕊试剂变红,原因是___________________ 。
(2)下图是氢气在氧气中燃烧的微观示意图(图中“O”代表氢原子,“●“代表氧原子)。

①参加该化学反应的最小粒子是__________ ( 填微粒符号)。
②写出该反应的化学方程式____________ 。
(1)物质的结构决定性质。
①根据Na、Al的原子结构示意图
 可推知,金属Na、Al的化学性质不同的原因是
可推知,金属Na、Al的化学性质不同的原因是②CO和CO2化学性质不同的原因是
③稀盐酸和稀硫酸都可使紫色石蕊试剂变红,原因是
(2)下图是氢气在氧气中燃烧的微观示意图(图中“O”代表氢原子,“●“代表氧原子)。

①参加该化学反应的最小粒子是
②写出该反应的化学方程式
14.从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液。其工艺流程如图所示:
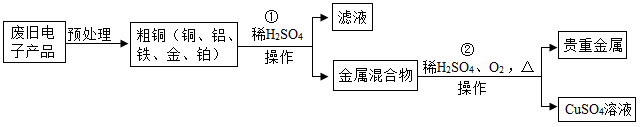
(1)图中“操作”的名称是_____ 。
(2)写出所得贵重金属中任意一种成分的化学式________ 。
(3)写出①中发生的化学反应方程式_______ ( 任写一种);该反应的基本类型为__ 。
(4)写出②中发生的化学反应方程式_______________ 。

(1)图中“操作”的名称是
(2)写出所得贵重金属中任意一种成分的化学式
(3)写出①中发生的化学反应方程式
(4)写出②中发生的化学反应方程式
15.如图所示是实验室制取气体的常用装置。请回答下列问题。
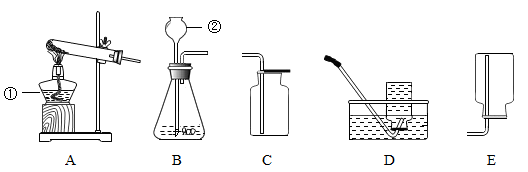
(1)A装置中仪器①的名称是______ 试管口略向下 倾斜的原因是___________ 。
(2)仪器②的名称是___ 该仪器的主要 作用是______________ 。
(3)实验室用加热氧酸钾制取氧气,应选择的发生装置为_______ (填字母序号);若要收集较纯净的氧气,应选择的收集装置是_________ ( 填字每序号)。写出过氧化氢溶液和二氧化锰的混合物制取氧气的化学方程式___________________________ 。
(4)制取氧气和二氧化碳均可选择的发生装置和收集装置为_____________ ( 填字母序号)。

(1)A装置中仪器①的名称是
(2)仪器②的名称是
(3)实验室用加热氧酸钾制取氧气,应选择的发生装置为
(4)制取氧气和二氧化碳均可选择的发生装置和收集装置为
16.不用火不用电,只需拆开发热包倒入凉水,就能享用美食的自热食品,受到消费者的追捧。

[查阅资料] I.发热包中物质的主要成分是生石灰,碳酸钠、铝粒。
Ⅱ.铝和强碱溶液反应生成氢气。
探究一:发热包的发热原理
(1)小明买了一盒自热米饭,取出发热包加入凉水,发生剧烈反应,迅速放出大量的热,写出产生该现象的主要化学反应方程式_____________ ;同时发热包内固体物质变硬、结块,依据观察到的实验现象,小明猜想发热包内的物质可能发生多个化学反应,写出其中一个反应的化学方程式 ______ 。
(2)发热包上的安全警示图标有“禁止明火”,其原因可能是_______________ 。
(3)小明向使用后的发热包中加入稀盐酸,并对产生的气体展开进一步探究。
探究二:确定气体的成分

[猜想与假设]小明认为该气体可能是a.H2; b.___ ; c.CO2,和H2的混合气体。
[实验设计]小明同学设计下图实验装置,对气体成分进行探究。
[实验验证]甲装置中的实验现象是____ .丁装置中黑色的粉末逐渐变为红色,试管口有水珠产生,证明猜想c正确。若甲、乙装置交换位置, ____ (填“能"或 不能”)确定气体中含有CO2,写出化学方程式并说明理由 ______ 。
[总结与反思]通过以上探究,小明做出如下反思:
a.发热包应密封防潮保存
b.能与水混合放出热量的物质均可做发热包的发热材料
c.使用后的发热包应包好按照垃圾分类投放
你认为其中正确的是_______ 。

[查阅资料] I.发热包中物质的主要成分是生石灰,碳酸钠、铝粒。
Ⅱ.铝和强碱溶液反应生成氢气。
探究一:发热包的发热原理
(1)小明买了一盒自热米饭,取出发热包加入凉水,发生剧烈反应,迅速放出大量的热,写出产生该现象的主要化学反应方程式
(2)发热包上的安全警示图标有“禁止明火”,其原因可能是
(3)小明向使用后的发热包中加入稀盐酸,并对产生的气体展开进一步探究。
探究二:确定气体的成分

[猜想与假设]小明认为该气体可能是a.H2; b.
[实验设计]小明同学设计下图实验装置,对气体成分进行探究。
[实验验证]甲装置中的实验现象是
[总结与反思]通过以上探究,小明做出如下反思:
a.发热包应密封防潮保存
b.能与水混合放出热量的物质均可做发热包的发热材料
c.使用后的发热包应包好按照垃圾分类投放
你认为其中正确的是
17.在100 g的某盐酸中加入硝酸银溶液,反应为AgNO3+HCl=HNO3+AgCl↓,至恰好完全反应,经过滤、洗涤、干燥、称量得到质量为28.7 g的AgCl沉淀,求盐酸的溶质质量分数。
 搜索
搜索
 难度系数:0.94
难度系数:0.94  答案解析
答案解析
 有奖纠错
有奖纠错
