全一卷
1.为预防骨质疏松,应给人体补充的元素是
| A.钙 | B.铁 | C.锌 | D.碘 |
2.空气中能供给动植物呼吸的气体是( )
| A.N2 | B.O2 | C.H2O | D.CO2 |
3.下列含金属元素的物质是
| A.H2S | B.P2O5 | C.AgNO3 | D.H2O |
4.下列不属于铁丝在氧气中燃烧现象的是
| A.放出热量 | B.产生大量白烟 |
| C.火星四射 | D.生成黑色固体 |
5.下列操作不正确的是
A.稀释浓硫酸 | B.点燃酒精灯 |
C.加热液体 | D.取用固体粉末 |
6.下列不能与稀盐酸反应的金属是
| A.Cu | B.Zn | C.Al | D.Mg |
7.下列物质含有氧分子的是
| A.O2 | B.H2O2 | C.H2CO3 | D.SO2 |
8.下列物质的用途中,利用其化学性质的是
| A.铜用于制作导线 |
| B.干冰用作制冷剂 |
| C.铜用于制作铜火锅 |
| D.赤铁矿用于炼铁 |
9.氯化钯(PdCl2)可用于检测CO。PdCl2中Pd的化合价为
| A.+1 | B.+2 | C.+3 | D.+4 |
10.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
| 温度/℃ | 20 | 30 | 40 |
| 溶解度/g | 31.6 | 45.8 | 63.9 |
| A.20℃时,100gKNO3饱和溶液中溶质质量为31.6g |
| B.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8% |
| C.30℃时,将50gKNO3放入100g水中得到150g溶液 |
| D.40℃时,100g水最多溶解63.9gKNO3 |
11.利用如图装置验证了空气中氧气的含量。下列叙述不正确的是


| A.实验前需检查装置气密性 | B.白磷的作用是消耗试管中的氧气 |
| C.白磷熄火、试管冷却后再打开止水夹 | D.最终量筒中液面约降至40mL刻度线处 |
12.甲酸(HCOOH)具有清洁制氢的巨大潜力,其分解前后分子种类变化的微观示意图如下:

下列说法正确的是

下列说法正确的是
| A.甲酸分子中氢、氧原子个数比为1:2 |
| B.乙中碳、氧元素质量比为1:2 |
| C.46g甲酸中氢元素质量为2g |
| D.生成甲与乙的分子个数比为2:1 |
13.垃圾分类是新时尚。补齐废弃物与垃圾桶的连线_______ 。


14.二氧化氯(ClO2)是安全消毒剂,杀菌能力优于Cl2,可由Na ClO2与Cl2反应制得。
(1)配平化学方程式:__  1
1 2
2
___ 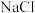 。
。
(2)71gCl2完全反应,理论上最多生成ClO2的质量为_______ g。
(1)配平化学方程式:
 1
1 2
2
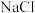 。
。(2)71gCl2完全反应,理论上最多生成ClO2的质量为
15.我国大力推广在盐分高,pH>9的土壤中种植海水稻。
(1)pH>9的土壤呈___(填“酸性”或“碱性”)。
(2)大米中主要含有的营养素是______。
(3)稻壳可用于制纳米SiO2,SiO2属于_______(填序号)。
A 氧化物 B 化合物 C 混合物
(1)pH>9的土壤呈___(填“酸性”或“碱性”)。
(2)大米中主要含有的营养素是______。
(3)稻壳可用于制纳米SiO2,SiO2属于_______(填序号)。
A 氧化物 B 化合物 C 混合物
16.从下图选择仪器,配置60g溶质质量分数为10%的NaCl溶液。

(1)需要称量NaCl的质量为____ g。
(2)量取水用到的仪器有____ (写名称)。
(3)从配好的溶液中倒出10g,其中溶质和溶剂的质量比为_____ 。

(1)需要称量NaCl的质量为
(2)量取水用到的仪器有
(3)从配好的溶液中倒出10g,其中溶质和溶剂的质量比为
17.阅读下面科普短文。氢能是公认的高热值清洁能源。目前,氢气的来源如图1所示。化石资源制氢最为成熟。水煤气变换反应: ,是化石资源制氢过称中的重要反应之一。北京大学团队研究了在不同温度下,多种催化剂对水煤气变换反应中CO转化率的影响,结果如图2所示。
,是化石资源制氢过称中的重要反应之一。北京大学团队研究了在不同温度下,多种催化剂对水煤气变换反应中CO转化率的影响,结果如图2所示。

电解水制氢过程简便,但造价高昂,利用太阳能制氢是未来的发展方向,“人造太阳”的探索也就应运而生。我国“人造太阳”大科学装置“东方超环”利用的是核聚变,当氘、氚核聚变温度达到1亿摄氏度、持续时间超过1000秒,就能形成持续反应,为水分解提供能量。2020年4月,“东方超环”实现了1亿摄氏度运行近10秒,取得重大突破。除了氢气的生产,其运输、储存和利用等仍面临诸多挑战,需要人们不断探索。
依据文章内容回答下列问题。
(1)目前氢气的主要来源是_____ 。
(2)图2中,催化剂为2%Au/a-MoC时,CO转化率和温度的关系是_______ 。
(3)根据下表信息可知氘、氚都属于氢元素,理由是________ 。
(4)下列说法正确的是___ (填序号)。
A a-MoC可使CO转化率接近100%
B水电解制氢的不足是造价高昂
C利用太阳能制氢是未来发展方向
D “东方超环”利用核聚变提供能量
 ,是化石资源制氢过称中的重要反应之一。北京大学团队研究了在不同温度下,多种催化剂对水煤气变换反应中CO转化率的影响,结果如图2所示。
,是化石资源制氢过称中的重要反应之一。北京大学团队研究了在不同温度下,多种催化剂对水煤气变换反应中CO转化率的影响,结果如图2所示。
电解水制氢过程简便,但造价高昂,利用太阳能制氢是未来的发展方向,“人造太阳”的探索也就应运而生。我国“人造太阳”大科学装置“东方超环”利用的是核聚变,当氘、氚核聚变温度达到1亿摄氏度、持续时间超过1000秒,就能形成持续反应,为水分解提供能量。2020年4月,“东方超环”实现了1亿摄氏度运行近10秒,取得重大突破。除了氢气的生产,其运输、储存和利用等仍面临诸多挑战,需要人们不断探索。
依据文章内容回答下列问题。
(1)目前氢气的主要来源是
(2)图2中,催化剂为2%Au/a-MoC时,CO转化率和温度的关系是
(3)根据下表信息可知氘、氚都属于氢元素,理由是
| 原子种类 | 质子数 | 中子数 | 核外电子数 |
| 氘 | 1 | 1 | 1 |
| 氚 | 1 | 2 | 1 |
(4)下列说法正确的是
A a-MoC可使CO转化率接近100%
B水电解制氢的不足是造价高昂
C利用太阳能制氢是未来发展方向
D “东方超环”利用核聚变提供能量
18.CuO是某种无机胶黏剂的组分之一,制备的部分流程如下图。
已知:CuO难溶于水。

(1)反应釜中发生的反应有:①
② ,其中属于复分解反应的是
,其中属于复分解反应的是____ (填“①”或“②”)。
(2)过滤器分离出的滤液中一定含有的溶质是__________ 。
已知:CuO难溶于水。

(1)反应釜中发生的反应有:①

②
 ,其中属于复分解反应的是
,其中属于复分解反应的是(2)过滤器分离出的滤液中一定含有的溶质是
19.从氯碱工业产生的盐泥中回收BaSO4,其主要工艺流程如下图。
已知:①盐泥的主要成分为BaSO4、NaCl、Mg(OH)2和CaCO3。
②BaSO4难溶于水,不与盐酸反应。

(1)除去NaCl,利用的性质是____ 。
(2)酸溶槽中发生中和反应的化学方程式为____ 。
(3)过滤器中分离出来的固体是____ 。
已知:①盐泥的主要成分为BaSO4、NaCl、Mg(OH)2和CaCO3。
②BaSO4难溶于水,不与盐酸反应。

(1)除去NaCl,利用的性质是
(2)酸溶槽中发生中和反应的化学方程式为
(3)过滤器中分离出来的固体是
20.请从A或B两题中任选一个作答,若均作答,按A计分。
(1)①中反应的化学方程式为__________ 。
(2)②中观察到的现象是___________ 。
| A氧气的制取与性质 | B二氧化碳的制取与性质 |
 |  |
(2)②中观察到的现象是
21.下列是两个关于水的实验。

(1)实验1,反应的化学方程式为________ 。
(2)下列说法正确的是______ (填序号)。
A 实验1,试管a中得到的气体能燃烧
B 实验1,反应前后原子的种类、个数均改变
C 实验2,水变化前后分子的种类不变

(1)实验1,反应的化学方程式为
(2)下列说法正确的是
A 实验1,试管a中得到的气体能燃烧
B 实验1,反应前后原子的种类、个数均改变
C 实验2,水变化前后分子的种类不变
22.补全实验报告。
| 装置及操作 | 现象 | 解释或结论 | |
 | (1)向1中滴加 | 铁片上附着红色固体,溶液颜色变浅 | Fe的金属活动性比Cu的强 |
| (2)向2中滴加盐酸 | 固体减少,得到黄色溶液 | 化学方程式: | |
| (3)向3中滴加足量盐酸 | Ca(OH)2能与盐酸反应 | ||
23.验证可燃物燃烧的条件。已知:白磷、红磷的着火点分别是40℃、240℃。
(1)Ⅰ中白磷不燃烧的原因是________ 。
(2)对比Ⅱ和Ⅲ,可验证可燃物燃烧的条件是______ 。
| 装置(夹持仪器已略去) | 步骤及现象 |
 | Ⅰ将一定量的白磷、红磷分别浸入80℃热水中(如左图所示)。白磷、红磷均不燃烧 Ⅱ.升高右侧漏斗至红磷露出水面。红磷不燃烧 Ⅲ.升高左侧漏斗至白磷露出水面。白磷燃烧 |
(2)对比Ⅱ和Ⅲ,可验证可燃物燃烧的条件是
24.丙酸钙为白色固体,易溶于水,可作食品防霉剂,国家标准规定了其用于制作面食、糕点时每千克面粉中的最大使用量。小组同学实验探究其性质和防霉的效果。
I.探究丙酸钙的性质
【进行实验】用下图装置(夹持仪器已略去)完成实验,记录如下:
【解释与结论】
(1)②中现象说明有CO2产生。CO2与石灰水反应的化学方程式为________ 。
(2)查阅资料得知丙酸钙与盐酸反应无气体生成。由实验②可得出的结论是_______ 。
Ⅱ.探究丙酸钙防霉的效果
【进行实验】分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
【解释与结论】
(3)设计第1组实验的目的是____ 。
(4)第2组,⑦中x为_______ 。
(5)对比第1组、第2组实验可得到的结论是______ 。
【反思与评价】
(6)某同学认为“制作面食、糕点时,丙酸钙用量越大越好”你是否同意此观点,并说明理由:_____ 。
I.探究丙酸钙的性质
【进行实验】用下图装置(夹持仪器已略去)完成实验,记录如下:
| 序号 | ① | ② |
| 装置 |  |  |
| 现象 | 试管内壁有水雾 | 注入酸后,有气泡产生,石灰水变浑浊 |
【解释与结论】
(1)②中现象说明有CO2产生。CO2与石灰水反应的化学方程式为
(2)查阅资料得知丙酸钙与盐酸反应无气体生成。由实验②可得出的结论是
Ⅱ.探究丙酸钙防霉的效果
【进行实验】分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
| 组别 | 第1组 | 第2组 | |||||||
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 配方 | 面粉/ g | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 |
| 酵母/ g | 0.75 | 0.75 | 0.75 | 0.75 | 0.75 | 0.75 | 0.75 | 0.75 | |
| 蔗糖/ g | 0 | 0 | 0 | 0 | 5 | 5 | x | 5 | |
| 丙酸钙/g | 0 | 0.06 | 0.10 | 0.15 | 0 | 0.06 | 0.10 | 0.15 | |
| 开始发霉时间 | 第3天 | 第4天 | 第5天 | 第6天 | 第3天 | 第4天 | 第5天 | 第6天 | |
【解释与结论】
(3)设计第1组实验的目的是
(4)第2组,⑦中x为
(5)对比第1组、第2组实验可得到的结论是
【反思与评价】
(6)某同学认为“制作面食、糕点时,丙酸钙用量越大越好”你是否同意此观点,并说明理由:
 搜索
搜索
 难度系数:0.94
难度系数:0.94  答案解析
答案解析
 有奖纠错
有奖纠错
