全一卷
1.空气成分中,体积分数最大的是( )
| A.氮气 | B.二氧化碳 | C.氧气 | D.稀有气体 |
2.下列金属活动性最强的是
| A.Mg | B.Ag | C.Cu | D.Zn |
3.下列食物富含蛋白质的是
| A.米饭 | B.黄瓜 | C.牛肉 | D.苹果 |
4.下列物质在氧气中燃烧,产生大量白烟的是
| A.木炭 | B.红磷 | C.蜡烛 | D.甲烷 |
5.决定元素种类的是
| A.中子数 | B.质子数 | C.核外电子数 | D.最外层电子数 |
6.下列物品所使用的主要材料属于有机合成材料的是
| A.塑料瓶 | B.纯棉衣服 | C.玻璃杯 | D.羊毛围巾 |
7.氢氧化钙可用于改良酸性土壤,其俗称是( )
| A.小苏打 |
| B.熟石灰 |
| C.生石灰 |
| D.纯碱 |
8.为防止佝偻病、骨质疏松,人体必需摄入的元素是
| A.钙 | B.铁 | C.锌 | D.碘 |
9.下列方法能鉴别空气、氧气和二氧化碳 3 瓶气体的是( )
| A.闻气味 | B.将集气瓶倒扣在水中 |
| C.观察颜色 | D.将燃着的木条伸入集气瓶中 |
10.下列数据是一些物质的 pH,其中呈碱性的是( )
A. 液体肥皂 液体肥皂 | B. 西瓜汁 西瓜汁 |
C. 酱油 酱油 | D. 柠檬 柠檬 |
11.能闻到花香的原因是( )
| A.分子的质量变小 | B.分子间有间隔 |
| C.分子在不断运动 | D.分子由原子构成 |
12.下列措施中,不能防止铁制品锈蚀的是
| A.喷漆 | B.镀一层耐腐蚀的金属 |
| C.制成不锈钢 | D.存放在潮湿的空气中 |
13.下列物质放入水中,能形成溶液的是
| A.面粉 | B.牛奶 | C.食盐 | D.植物油 |
14.下列物质必须密封保存的是
| A.氯化钠 | B.木炭 | C.石灰石 | D.浓硫酸 |
15.下列实验操作正确的是
A. 稀释浓硫酸 稀释浓硫酸 | B. 倾倒液体 倾倒液体 | C. 过滤 过滤 | D. 称量固体 称量固体 |
16.下列符号能表示两个氧分子的是( )
A.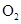 | B.2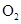 | C.2O | D.2 |
17.下列不属于新能源的是
| A.潮汐能 | B.太阳能 | C.风能 | D.石油 |
18.下列化学方程式书写正确的是( )
A.2P+5O2 P2O5 P2O5 | B.2KMnO4 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑ |
| C.2CO+O2═2CO2 | D.H2SO4+NaOH═NaSO4+H2O |
19.下列物质的用途中,利用其物理性质的是
| A.干冰用作冷冻剂 | B.硫酸用于处理碱性废液 |
| C.氧气用于气焊 | D.生石灰用作干燥剂 |
20.用下列装置进行实验,不能达到实验目的是( )
A. 干燥CO2 干燥CO2 | B. 收集O2 收集O2 |
C. 验证CO2性质 验证CO2性质 | D. 监控气体流速 监控气体流速 |
21.金属钛(Ti)抗腐蚀性能好,露置于空气中数年,仍光亮如初。以金红石(主要成分是TiO2)为原料生产金属钛的步骤主要有:①在高温下,向金红石与焦炭的混合物中通入氯气(Cl2),得到TiCl4和一种可燃性气体;②在稀有气体环境和加热条件下,用Mg和TiCl4反应得到Ti和MgCl2。下列说法不正确的是( )
A.①中的反应为TiO2+C+2Cl2 TiCl4+CO2 TiCl4+CO2 |
| B.②中的稀有气体的作用是隔绝空气 |
| C.②中发生的反应为置换反应 |
| D.金属钛在常温下不与O2反应 |
22.下列实验操作能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 验证NaCl 溶液中混有盐酸 | 取少量溶液,滴加无色酚酞溶液 |
| B | 比较Fe、Cu、Al的金属活动性 | 铁丝浸入CuSO4溶液,铜丝浸入AgNO3溶液 |
| C | 除去铁制品上的铁锈 | 将铁制品长时间浸泡在足量的稀硫酸中 |
| D | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、蒸发 |
| A.A | B.B | C.C | D.D |
23.甲和乙在一定条件下反应生成丙和丁,结合微观示意图分析,下列结论正确的是( )


| A.丙的相对分子质量为24 | B.生成的丙和丁的分子个数比为2:1 |
| C.反应前后分子总数不变 | D.参加反应的甲和乙的质量比为22:3 |
24.a、b 两种物质的溶解度曲线如图所示.下列说法不正确的是( )


| A.15℃时,a、b 的溶解度均为20g |
| B.加水或升温均可使b的饱和溶液变为不饱和溶液 |
| C.将 30℃时a的饱和溶液降温至15℃,溶质的质量分数不变 |
| D.分别向100g 水中加入20ga和 b,升温至30℃,所得溶液均 为饱和溶液 |
25.已知:Ca(HCO3 )2 CaCO3+CO2↑+H2O.下列图象表示一定质量的 Ca(HCO3)2 受热过程中某些量随时间的变化趋势(该过程的 CaCO3 不分解),其中不正确的是( )
CaCO3+CO2↑+H2O.下列图象表示一定质量的 Ca(HCO3)2 受热过程中某些量随时间的变化趋势(该过程的 CaCO3 不分解),其中不正确的是( )
 CaCO3+CO2↑+H2O.下列图象表示一定质量的 Ca(HCO3)2 受热过程中某些量随时间的变化趋势(该过程的 CaCO3 不分解),其中不正确的是( )
CaCO3+CO2↑+H2O.下列图象表示一定质量的 Ca(HCO3)2 受热过程中某些量随时间的变化趋势(该过程的 CaCO3 不分解),其中不正确的是( )A.  | B.  |
C.  | D.  |
26.铝元素与人类关系密切.
(1)铝是地壳中含量最高的_____ 元素.
(2)元素周期表中铝元素的信息如图所示,其原子的核外电子数为_____ .

(3)铝元素在自然界中主要以Al2O3存在,Al2O3属于_____ (填字母序号).
A 单质 B 氧化物 C 碱 D 盐
(4)工业用电解熔融Al2O3的方法冶炼铝,化学方程式为2Al2O3 4Al+3O2↑,该反应属于基本反应类型中的
4Al+3O2↑,该反应属于基本反应类型中的_____ 反应.
(5)铝可制成蒸锅,主要利用铝的延展性和_____ 性.
(6)药品“氢氧化铝[Al(OH)3]”片剂能与胃酸(主要成分为盐酸)发生中和反应,治疗胃酸过多症,该反应的化学方程式为_____ .
(1)铝是地壳中含量最高的
(2)元素周期表中铝元素的信息如图所示,其原子的核外电子数为

(3)铝元素在自然界中主要以Al2O3存在,Al2O3属于
A 单质 B 氧化物 C 碱 D 盐
(4)工业用电解熔融Al2O3的方法冶炼铝,化学方程式为2Al2O3
 4Al+3O2↑,该反应属于基本反应类型中的
4Al+3O2↑,该反应属于基本反应类型中的(5)铝可制成蒸锅,主要利用铝的延展性和
(6)药品“氢氧化铝[Al(OH)3]”片剂能与胃酸(主要成分为盐酸)发生中和反应,治疗胃酸过多症,该反应的化学方程式为
27.水是生命之源.
(1)活性炭常用于净水,其作用是_____ 、过滤水中的杂质.
(2)生活中常用_____ 来区分硬水和软水.
(3)电解水实验如图所示,与直流电源正极相连的玻璃管中生成的气体是_____ ,反应的化学方程式为_____ .

(4)配制 500g 溶质的质量分数为 10%的葡萄糖溶液,需葡萄糖和水的质量分别为_____ ,主要步骤有称量、量取、_____ .
(1)活性炭常用于净水,其作用是
(2)生活中常用
(3)电解水实验如图所示,与直流电源正极相连的玻璃管中生成的气体是

(4)配制 500g 溶质的质量分数为 10%的葡萄糖溶液,需葡萄糖和水的质量分别为
28.二氧化碳不仅能产生温室效应,还能作化工原料.
(1)化石燃料燃烧会产生大量的CO2.天然气充分燃烧的化学方程式为____ .
(2)膜分离是一种常用的分离技术.二氧化硅(SiO2)能用于制造CO2分离膜.CO2通过此膜后被氨水吸收(如图所示),转化为可作氮肥的NH4HCO3。

①SiO2中硅元素的化合价为____ ;
②NH4HCO3固体中氮元素的质量分数为_______ 。(计算结果精确到0.1%)
(3)CO2形成的超临界CO2流体可用于从香兰草豆荚粉中提取香兰素(C8H8O3)

①香兰素由____ 3种元素组成。
②由香兰素的乙醇溶液得到香兰素的过程中,发生的是__ 变化。
③以上提取香兰素的过程中,可循环使用的物质有___ 。
(1)化石燃料燃烧会产生大量的CO2.天然气充分燃烧的化学方程式为
(2)膜分离是一种常用的分离技术.二氧化硅(SiO2)能用于制造CO2分离膜.CO2通过此膜后被氨水吸收(如图所示),转化为可作氮肥的NH4HCO3。

①SiO2中硅元素的化合价为
②NH4HCO3固体中氮元素的质量分数为
(3)CO2形成的超临界CO2流体可用于从香兰草豆荚粉中提取香兰素(C8H8O3)

①香兰素由
②由香兰素的乙醇溶液得到香兰素的过程中,发生的是
③以上提取香兰素的过程中,可循环使用的物质有
29.合金是重要的金属材料.
(1)下列物品所使用的主要材料属于合金的是_____ (填字母序号,下同).
A 青花瓷瓶 B 橡胶充气艇 C 不锈钢锅
(2)生铁是常用的合金,生铁属于_____ (填“纯净物”或“混合物”).
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图1所示),纯铜片上留下明显的划痕,说明_____ .

(4)黄铜渣中约含 Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质.处理黄铜渣可得到硫酸锌,其主要流程如图2(杂质不溶于水、不参与反应):
已知:ZnO+H2SO4═ZnSO4+H2O; CuO+H2SO4═CuSO4+H2O
①Ⅱ中反应的化学方程式为_____ .
②下列说法正确的是_____ .
a.Ⅰ、Ⅱ中的操作均包含过滤
b.溶液A中ZnSO4的质量大于CuSO4
c.溶液A的质量小于溶液B
d.溶液C中溶质的质量分数小于溶液B.
(1)下列物品所使用的主要材料属于合金的是
A 青花瓷瓶 B 橡胶充气艇 C 不锈钢锅
(2)生铁是常用的合金,生铁属于
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图1所示),纯铜片上留下明显的划痕,说明

(4)黄铜渣中约含 Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质.处理黄铜渣可得到硫酸锌,其主要流程如图2(杂质不溶于水、不参与反应):
已知:ZnO+H2SO4═ZnSO4+H2O; CuO+H2SO4═CuSO4+H2O
①Ⅱ中反应的化学方程式为
②下列说法正确的是
a.Ⅰ、Ⅱ中的操作均包含过滤
b.溶液A中ZnSO4的质量大于CuSO4
c.溶液A的质量小于溶液B
d.溶液C中溶质的质量分数小于溶液B.
30.下列字母 A~H 表示初中化学常见的物质,它们由氢、碳、氧、氯、钠、钙、铁中的 2﹣3种元素组成.
(1)A 有强烈的腐蚀性,易潮解,无色酚酞溶液遇A的稀溶液变红,A 的俗称是_____ .
(2)红色粉末B与气体C反应得到黑色粉末,化学方程式为_____ .
(3)D和E均含两种元素.如图所示,将D的溶液滴入锥形瓶中,溶液变黄,有气泡产生;烧杯中聚集的肥皂泡能被点燃.E中含有的元素是_____ ,锥形瓶中发生反应的化学方程式为_____ .

(4)F、G、H 分别与D的溶液反应,均有水生成.将F的溶液与G的溶液混合,生成白色沉淀H.F与G反应的化学方程式为_____ .
(1)A 有强烈的腐蚀性,易潮解,无色酚酞溶液遇A的稀溶液变红,A 的俗称是
(2)红色粉末B与气体C反应得到黑色粉末,化学方程式为
(3)D和E均含两种元素.如图所示,将D的溶液滴入锥形瓶中,溶液变黄,有气泡产生;烧杯中聚集的肥皂泡能被点燃.E中含有的元素是

(4)F、G、H 分别与D的溶液反应,均有水生成.将F的溶液与G的溶液混合,生成白色沉淀H.F与G反应的化学方程式为
31.据如图回答问题.

(1)仪器a的名称是_________ 。
(2)实验室制取氧气时,选用的收集装置是____ (填字母序号,下同)。如图E所示,铁丝与氧气反应的化学方程式为______________________________ 。
(3)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为___________________________ ,选用的发生装置是_____ 。如图 F 所示,将二氧化碳倒入烧杯中,观察到燃烧的蜡烛自下而上依次熄灭,说明二氧化碳具有的性质是_______________________________ 。

(1)仪器a的名称是
(2)实验室制取氧气时,选用的收集装置是
(3)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为
32.用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.已知:白磷的着火点为40℃.

(1)H2O2稀溶液与MnO2接触时发生反应的化学方程式为_____ .
(2)实验1中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是_____ ; 推入H2O2溶液后,观察到烧杯中的现象是_____ .
(3)实验2中,推入H2O2溶液后,观察到木炭燃烧得更剧烈,由此得出氧气的性质是_____ ;木炭熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶.该实验中,集气瓶内压强的变化过程是_____ .

| 内容 步骤 | 【实验1】研究燃烧条件 | 【实验2】研究氧气性质 |
| Ⅰ | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导 管口放置一小块白磷,塞 紧瓶塞 | 烧杯中盛有NaOH溶液,燃烧匙中放入木炭 点燃木炭后,迅速将燃烧 匙伸入瓶中,塞紧瓶塞 |
| Ⅱ | 推入适量H2O2 溶液 | 推入适量H2O2 溶液 |
(1)H2O2稀溶液与MnO2接触时发生反应的化学方程式为
(2)实验1中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是
(3)实验2中,推入H2O2溶液后,观察到木炭燃烧得更剧烈,由此得出氧气的性质是
33.碳酸钠和碳酸氢钠是生活中常见的盐,通过实验验证、探究它们的化学性质.
(查阅资料)
①Na2CO3+CaCl2═CaCO3↓+2NaCl
②2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
③Ca(HCO3)2 易溶于水.
④CaCl2溶液分别与 NaHCO3、Na2CO3溶液等体积混合现象(表中的百分数为溶液中溶质的质量分数):
(进行实验)
(解释与结论)
(1)实验1中,NaHCO3与盐酸反应的化学方程式为_____ .
(2)实验2中,试剂a为_____ .
(3)实验3中,NaHCO3与 CaCl2反应的化学方程式为:2NaHCO3+CaCl2═_____ +_____ +_____ +H2O
(反思与评价)
(1)实验 2 中,加热 NaHCO3后,试管Ⅰ中残留固体成分可能为_____ (写出所有可能).
(2)资料④中,NaHCO3溶液与 CaCl2溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是_____ .
(3)用2种不同的方法鉴别Na2CO3和NaHCO3固体,实验方案分别为:
①_____ .
②_____ .
(查阅资料)
①Na2CO3+CaCl2═CaCO3↓+2NaCl
②2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O③Ca(HCO3)2 易溶于水.
④CaCl2溶液分别与 NaHCO3、Na2CO3溶液等体积混合现象(表中的百分数为溶液中溶质的质量分数):
| | NaHCO3 | Na2CO3 | |||
| 0.1% | 1% | 5% | 0.1% | ||
| CaCl2 | 0.1% | 无明显现象 | 有浑浊 | 有浑浊 | 有浑浊 |
| 1% | 无明显现象 | 有浑浊 | 有浑浊,有微小气泡 | 有沉淀 | |
| 5% | 无明显现象 | 有浑浊 | 有沉淀,有大量气泡 | 有沉淀 | |
(进行实验)
| 序号 | 实验装置 | 主要实验步骤 | 实验现象 |
| 实验 1 |  | 向2支试管中分别加入少量Na2CO3和 NaHCO3溶液,再分别滴加盐酸 | 2 支试管中均有气泡产生 |
| 实验 2 |  | 向Ⅱ中加入试剂a,向Ⅰ中加入少量Na2CO3或 NaHCO3固体,分别加热一段时间 | Na2CO3受热时Ⅱ中无明显现象 NaHCO3受热时Ⅱ中出现浑浊 |
| 实验 3 |  | 向Ⅱ中加入试剂 a,向Ⅰ中加入少量 5%的 NaHCO3溶液,再滴加 5%的 CaCl2溶液 | Ⅰ中出现浑浊,有气泡产生Ⅱ中出现浑浊 |
(解释与结论)
(1)实验1中,NaHCO3与盐酸反应的化学方程式为
(2)实验2中,试剂a为
(3)实验3中,NaHCO3与 CaCl2反应的化学方程式为:2NaHCO3+CaCl2═
(反思与评价)
(1)实验 2 中,加热 NaHCO3后,试管Ⅰ中残留固体成分可能为
(2)资料④中,NaHCO3溶液与 CaCl2溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是
(3)用2种不同的方法鉴别Na2CO3和NaHCO3固体,实验方案分别为:
①
②
34.科学研究表明,利用化学反应2Na+H2 2NaH可实现氢气的存储,计算230g金属钠最多可吸收氢气的质量_____。
2NaH可实现氢气的存储,计算230g金属钠最多可吸收氢气的质量_____。
 2NaH可实现氢气的存储,计算230g金属钠最多可吸收氢气的质量_____。
2NaH可实现氢气的存储,计算230g金属钠最多可吸收氢气的质量_____。35.某厂烟气中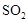 的平均含量为
的平均含量为 ,用
,用 硫化钠
硫化钠 溶液恰好能吸收
溶液恰好能吸收 该厂烟气中
该厂烟气中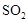 ,反应的化学方程式为:
,反应的化学方程式为: 。
。
求理论上得到 溶液的质量(假设烟气中其他成分不能被吸收)_______。
溶液的质量(假设烟气中其他成分不能被吸收)_______。
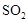 的平均含量为
的平均含量为 ,用
,用 硫化钠
硫化钠 溶液恰好能吸收
溶液恰好能吸收 该厂烟气中
该厂烟气中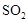 ,反应的化学方程式为:
,反应的化学方程式为: 。
。求理论上得到
 溶液的质量(假设烟气中其他成分不能被吸收)_______。
溶液的质量(假设烟气中其他成分不能被吸收)_______。 搜索
搜索
 难度系数:0.94
难度系数:0.94  答案解析
答案解析
 有奖纠错
有奖纠错
