全一卷
1.下列变化属于化学变化的是( )
| A.汽油挥发 | B.瓷碗破碎 | C.钢铁生锈 | D.粉笔折断 |
2.钙是构成人体骨骼和牙齿的重要组分.这里的“钙”是指
| A.钙元素 | B.钙原子 | C.钙单质 | D.钙离子 |
3.化肥对农业的高产丰收具有重要作用。下列物质中属于复合肥的是( )
| A.K2SO4 | B.Ca(H2PO4)2 | C.CO(NH2)2 | D.KNO3 |
4.将少量下列物质分别放入水中,充分搅拌后,不能得到溶液的是( )
| A.食盐 | B.蔗糖 | C.菜籽油 | D.酒精 |
5.青少年每天应从食物中摄入足够的维生素以保证身体生长的需要。下列食物中富含维生素的是( )
| A.豆油 | B.苹果 | C.米粉 | D.牛肉 |
6.下列实验操作中,正确的是( )
A. 称量固体质量 称量固体质量 | B. 测定溶液的pH 测定溶液的pH |
C. 稀释浓硫酸 稀释浓硫酸 | D. 读液体体积 读液体体积 |
7.下列化学反应中属于置换反应的是( )
A.H2+C12 2HCl 2HCl |
| B.CaO+2HCl═CaCl2+H2O |
C.C+2CuO 2Cu+CO2↑ 2Cu+CO2↑ |
D.CaCO3 CaO+CO2↑ CaO+CO2↑ |
8.如图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子,下列说法正确的是( )


| A.反应前后原子的种类和数目保持不变 |
| B.该反应的基本反应类型为复分解反应 |
| C.由大量微粒甲聚集成的物质是单质 |
| D.参加反应的甲、乙两种反应物的分子个数比为1:1 |
9.中国科学家屠呦呦因为发现青蒿素﹣一种用于治疗疟疾的药物,挽救了全球特别是发展中国家数百万人的生命,从而获得了2015年诺贝尔生理学或医学奖。下列关于青蒿素(C15H22O5)的说法正确的是( )
| A.青蒿素由42个原子构成 |
| B.青蒿素中碳元素的质量分数最大 |
| C.青高素中C、H、O三种元素的质量比为15:22:5 |
| D.青高素的相对分子质量为282g |
10.工业上可以用电解饱和食盐水的方法来制取氯气、氢气及另外一种重要的化工原料,反应方程式2NaCl+2H2O 2X+Cl2
2X+Cl2 +H2
+H2 方程式已配平
方程式已配平 ,则X的化学式为
,则X的化学式为

 2X+Cl2
2X+Cl2 +H2
+H2 方程式已配平
方程式已配平 ,则X的化学式为
,则X的化学式为

| A.HCl | B.NaOH | C.NaClO | D. |
11.有X、Y、Z三种金属,分别置于稀硫酸中,只有Y金属表面有气泡生成:将Z放入X的盐溶液中,Z表面有X生成。据此判断这三种金属的活动性由弱到强的顺序是( )
| A.Y Z X | B.Z X Y | C.X Y Z | D.X Z Y |
12.除去下列各物质中混有的少量杂质,所用试剂、方法正确的是( )
| 序号 | 物质 | 杂质 | 方法 |
| A | NaCl | NaOH | 加入足量稀H2SO4 |
| B | CO2 | CO | 通过足量NaOH溶液,干燥 |
| C | FeCl2 | CuCl2 | 加入过量铁粉,过滤 |
| D | KOH | K2CO3 | 加入足量稀盐酸至不再产生气泡 |
| A.A | B.B | C.C | D.D |
13.下列四个图象分别对应四个变化过程,其中正确的是( )
A. 如图表示向一定量的饱和氯化钠溶液中加入氯化钠固体 如图表示向一定量的饱和氯化钠溶液中加入氯化钠固体 |
B. 如图表示用等体积、等浓度的双氧水制取氧气 如图表示用等体积、等浓度的双氧水制取氧气 |
C. 如图表示向一定溶质质量分数的盐酸中滴加氢氧化钠溶液至过量 如图表示向一定溶质质量分数的盐酸中滴加氢氧化钠溶液至过量 |
D. 如图表示等质量的锌、铁与足量的稀硫酸反应 如图表示等质量的锌、铁与足量的稀硫酸反应 |
14.用化学用语填空:
(1)4个氢氧根离子_____。
(2)2个氧原子_____。
(3)K2Cr2O7中Cr元素的化合价_____。
(1)4个氢氧根离子_____。
(2)2个氧原子_____。
(3)K2Cr2O7中Cr元素的化合价_____。
15.元素周期表是学习和研究化学的重要工具,请回答下列问题。
(1)元素周期表中不同种元素间最本质的区别是_____
A 相对原子质量不同 B 质子数不同 C 中子数不同
(2)元素周期表中硫元素的有关信息如图所示,硫元素属于_____(填“金属”或“非金属”)元素,硫原子原子核内有_____个质子
(3)硫原子的原子结构示意图_____,该原子在化学反应中_____(填“得到”或“失去”)电子,硫元素与钠元素形成的化合物的化学式为_____。
(1)元素周期表中不同种元素间最本质的区别是_____
A 相对原子质量不同 B 质子数不同 C 中子数不同
(2)元素周期表中硫元素的有关信息如图所示,硫元素属于_____(填“金属”或“非金属”)元素,硫原子原子核内有_____个质子
(3)硫原子的原子结构示意图_____,该原子在化学反应中_____(填“得到”或“失去”)电子,硫元素与钠元素形成的化合物的化学式为_____。

16.如图是a、b、c三种固体物质的溶解度曲线,请根据图示回答下列问题:

(1)在t2℃时,a、b、c的溶解度的大小关系是_____
(2)P点是a、c两条曲线的交点,其含义是_____ 。
(3)t1℃时,将20ga固体放入50g水中,充分溶解后,所得溶液的质量是_____ g。
(4)若a中含有少量的b杂质,提纯a的方法是_____ 结晶。

(1)在t2℃时,a、b、c的溶解度的大小关系是
(2)P点是a、c两条曲线的交点,其含义是
(3)t1℃时,将20ga固体放入50g水中,充分溶解后,所得溶液的质量是
(4)若a中含有少量的b杂质,提纯a的方法是
17.工业生产、人类生活与化学有着密切的关系,请你用C、H、O、S、Na五种元素中的一种或几种(可重复使用)写出符合下列要求的物质的化学式:
(1)一种可用于除铁锈的酸:_____
(2)最简单的一种有机物:_____
(3)约占空气体积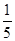 的气体:_____
的气体:_____
(4)一种有毒气体,可用于铁的冶炼:_____。
(1)一种可用于除铁锈的酸:_____
(2)最简单的一种有机物:_____
(3)约占空气体积
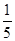 的气体:_____
的气体:_____(4)一种有毒气体,可用于铁的冶炼:_____。
18.熄灭酒精灯的时候要用灯帽盖灭,其原理是_____,生活中软化水的方法是_____。
19.做铁丝与氧气燃烧的实验时,要预先在盛氧气的集气瓶中放入少量水,其目的是_____,铁丝在氧气中燃烧的化学方程式为_____。
20.氧化钙俗名生石灰,某同学针对氧化钙设计了如下实验方案:

(1)分离A中难溶物的操作Ⅰ叫________ 。
(2)如果要用实验证明B中不是水而是一种溶液,可以选择下列________ (填序号)进行实验。
①稀盐酸 ②二氧化碳 ③氯化钠溶液
(3)操作Ⅱ是加入某种物质使无色澄清溶液出现白色固体,如果加入的是饱和碳酸钠溶液,则反应的化学方程式为________________________ ;如果加入的是固体氢氧化钠(全部溶解),白色固体的化学式是________ 。

(1)分离A中难溶物的操作Ⅰ叫
(2)如果要用实验证明B中不是水而是一种溶液,可以选择下列
①稀盐酸 ②二氧化碳 ③氯化钠溶液
(3)操作Ⅱ是加入某种物质使无色澄清溶液出现白色固体,如果加入的是饱和碳酸钠溶液,则反应的化学方程式为
21.根据如图装置,结合所学化学知识回答下列问题

(1)写出标号仪器①的名称:_____。
(2)实验室选择装置B用高锰酸钾制取氧气时,你认为B装置存在的问题是_____,该反应的化学方程式是_____,如果用排空气法收集氧气,则验满的方法是_____。
(3)实验室制取CO2可选择的发生装置是_____(填字母),该反应的化学方程式为_____。
(4)通常情况下,氨气(NH3)是一种无色、有刺激性气味的有毒气体,密度比空气小,极易溶于水且水溶液显碱性。实验室里,用氢氧化钙固体和氯化铵固体反应制取氨气。实验室制取氨气选择的发生装置是_____(填字母),若选择E装置收集氨气,气体应该从_____(填“a”或“b”)口进入。实验过程中多余的氨气用酸性溶液吸收,吸收的目的是_____。

(1)写出标号仪器①的名称:_____。
(2)实验室选择装置B用高锰酸钾制取氧气时,你认为B装置存在的问题是_____,该反应的化学方程式是_____,如果用排空气法收集氧气,则验满的方法是_____。
(3)实验室制取CO2可选择的发生装置是_____(填字母),该反应的化学方程式为_____。
(4)通常情况下,氨气(NH3)是一种无色、有刺激性气味的有毒气体,密度比空气小,极易溶于水且水溶液显碱性。实验室里,用氢氧化钙固体和氯化铵固体反应制取氨气。实验室制取氨气选择的发生装置是_____(填字母),若选择E装置收集氨气,气体应该从_____(填“a”或“b”)口进入。实验过程中多余的氨气用酸性溶液吸收,吸收的目的是_____。
22.现有含杂质的氢氧化钙样品10g向其中加入10%的稀盐酸溶液73g恰好完全反应(杂质不参与反应),求样品中氢氧化钙的质量分数_____。
 搜索
搜索
 难度系数:0.94
难度系数:0.94  答案解析
答案解析
 有奖纠错
有奖纠错
