全一卷
1.下列属于化学变化的是
| A.冰雪融化 | B.纸张燃烧 | C.水分蒸发 | D.矿石粉碎 |
2.地壳中含量最多的金属元素是( )
| A.氧 | B.硅 | C.铝 | D.铁 |
3.下列属于氧化物的是
| A.O2 | B.SO2 | C.KCl | D.NaOH |
4.下列物质在氧气中燃烧,火星四射、生成黑色固体的是
| A.木炭 | B.铁丝 | C.蜡烛 | D.红磷 |
5.下列物质放入水中,能形成溶液的是
| A.面粉 | B.牛奶 | C.白糖 | D.植物油 |
6.下列物品所使用的主要材料为有机合成材料的是




| A.塑料玩具 | B.纯棉帽子 | C.陶瓷餐具 | D.黄金饰品 |
7.碳酸钠可用于制造玻璃,其俗称是
| A.小苏打 | B.熟石灰 | C.生石灰 | D.纯碱 |
8.决定元素种类的是
| A.质子数 | B.电子数 | C.中子数 | D.核外电子数 |
9.配制50 g溶质的质量分数为 6%的氯化钠溶液,不需要的仪器是
| A.蒸发皿 | B.玻璃棒 | C.烧杯 | D.量筒 |
10.下列实验操作中,正确的是
A. 滴加液体 滴加液体 | B. 稀释浓硫酸 稀释浓硫酸 | C. 检查气密性 检查气密性 | D. 熄灭酒精灯 熄灭酒精灯 |
11.下列化学符号中,表示2个氢分子的是
| A.H2 | B.2H | C.2H2 | D.2H+ |
12.下列做法不利于保护环境的是
| A.垃圾分类处理 | B.使用一次性塑料餐盒 |
| C.使用节水龙头 | D.乘坐公共交通工具 |
13.下列数据是一些物质的pH,其中呈碱性的是


| A.牙膏 | B.胡萝卜 | C.西红柿 | D.食醋 |
14.下列物质质量置于空气中,一段时间后,质量减小的是
| A.碳酸钙 | B.氯化钠 | C.浓盐酸 | D.氢氧化钠 |
15.镁有“国防金属”的美誉。在元素周期表中,镁元素的信息如下图所示,对图中信息解释不正确的是


| A.原子序数为12 |
| B.核外电子数为 24 |
| C.元素符合为Mg |
| D.相对原子质量为24.31 |
16.下列方法能鉴别氧气和空气的是
| A.闻气味 | B.将集气瓶倒扣在水中 |
| C.观察颜色 | D.将带火星的木条伸入集气瓶中 |
17.下列化学方程式书写正确的是
A.2P+5O2 P2O5 P2O5 | B.Fe2O3+3CO=2Fe+3CO2 |
C.H2O2 H2↑+O2↑ H2↑+O2↑ | D.NaHCO3+HCl=NaCl+H2O+CO2 |
18.下列物质的用途中,利用其化学性质的是
| A.液氮用作冷冻剂 | B.干冰用于人工降雨 |
| C.氧气用于气焊 | D.浓硫酸用作干燥剂 |
19.固体碘受热升华,下列关于此过程的说法正确的是
| A.碘分子质量变大 | B.碘分子间的间隔变大 |
| C.碘分子体积变小 | D.碘分子运动速率不变 |
20.工业冶炼金属锰的原理是3MnO2+4Al 3Mn+2Al2O3,该反应属于
3Mn+2Al2O3,该反应属于
 3Mn+2Al2O3,该反应属于
3Mn+2Al2O3,该反应属于| A.置换反应 | B.化合反应 | C.分解反应 | D.复分解反应 |
21.下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向醋酸中加入氢氧化钠溶液 | 无明显现象 | 二者之间不发生反应 |
B | 向溶质的质量分数为5%的过氧化氢溶液中加入少量氧化铜 | 有大量气泡产生 | 氢氧化钠起催化作用 |
C | 两根铁丝分别伸入硫酸铜溶液和硝酸银溶液中 | 两根铁丝上均有固体附着 | 金属的活动性顺序为Fe>Cu>Ag |
D | 用导管分别对准浸没在热水和冷水中的白磷通空气 | 热水中的白磷燃烧,冷水中的白磷不燃烧 | 燃烧的条件之一是温度达到着火点 |
| A.A | B.B | C.C | D.D |
22.肼(N2H4)是一种无色油状液体,有刺激性气味,有吸湿性。点燃时,迅速而完全燃烧,生成 N2和 H2O,并放出大量的热。下列有关N2H4的说法不正确的是
| A.应密封保存 | B.完全燃烧的反应属于复分解反应 |
| C.可用作燃料 | D.其中氮元素与氢元素的质量比为7∶1 |
23.下列四个图象中,能正确反应对应变化关系的是
A. 向一定量的氢氧化钠溶液中滴加稀盐酸 向一定量的氢氧化钠溶液中滴加稀盐酸 |
B. 向一定量的稀盐酸中加入大理石 向一定量的稀盐酸中加入大理石 |
C. 向一定量的稀盐酸中加入铁粉 向一定量的稀盐酸中加入铁粉 |
D. 加热一定量的高锰酸钾固体 加热一定量的高锰酸钾固体 |
24.a、b、c 三种物质的溶解度曲线如下图所示。取等质量 ℃的 a、b、c 三种物质的饱和溶液,分别蒸发等量水后恢复至
℃的 a、b、c 三种物质的饱和溶液,分别蒸发等量水后恢复至 ℃。下列说法不正确的是
℃。下列说法不正确的是

 ℃的 a、b、c 三种物质的饱和溶液,分别蒸发等量水后恢复至
℃的 a、b、c 三种物质的饱和溶液,分别蒸发等量水后恢复至 ℃。下列说法不正确的是
℃。下列说法不正确的是 
| A.原饱和溶液中,溶质的质量分数 a>b="c" |
| B.恢复至 t2℃时,析出溶质的质量 a>b=c |
| C.恢复至t2℃时,三种溶液一定都是饱和溶液 |
| D.若继续降温至 t1℃,三种溶液一定都是饱和溶液 |
25.某同学欲测定Na2CO₃和NaCl 固体混合物中Na2CO₃的质量分数,分别取a g 样品,按下列方案进行实验,合理的是
| A.与足量稀盐酸充分反应,用排水法收集到 VmL气体 |
| B.与足量稀盐酸充分反应,称量反应后的溶液,质量为 m1g |
| C.与足量Ca(OH)2溶液充分反应,将沉淀过滤、洗涤、干燥,得到m2 g固体 |
| D.与足量浓盐酸充分反应,逸出的气体用NaOH固体充分吸收,固体质量增加 m3g |
26.碳元素是组成许多物质的基本元素。
(1)下列含碳元素的物质中,属于有机物的是 ___(填字母序号)。
A.碳酸钙 B.乙醇(C2H5OH ) C.二氧化碳
(2)化石燃料主要包括煤、 和天然气,它们都含有碳元素,其中天然气的主要成分是 (写化学式)。
(3)很多天然矿石中含有碳元素,菱锰矿的主要成分是碳酸锰( MnCO3),其中锰元素的化合价 。
(4)在 440℃和高压条件下,金属钠与二氧化碳反应能生成金刚石(C)和碳酸钠,该反应的化学方程式为 。
(5)将吸入的石油挤出后仍可恢复原是已知最轻的固体材料(如下图所示),由碳元素组成,具有多孔结构,
弹性好。它对石油有很强的吸附能力(不吸水),将吸入的石油挤出后仍可恢复原状。下列关于碳海绵的说法正确的是 (填字母序号)。

A.具有吸附性
B.可重复使用
C.可处理海上石油泄漏
(1)下列含碳元素的物质中,属于有机物的是 ___(填字母序号)。
A.碳酸钙 B.乙醇(C2H5OH ) C.二氧化碳
(2)化石燃料主要包括煤、 和天然气,它们都含有碳元素,其中天然气的主要成分是 (写化学式)。
(3)很多天然矿石中含有碳元素,菱锰矿的主要成分是碳酸锰( MnCO3),其中锰元素的化合价 。
(4)在 440℃和高压条件下,金属钠与二氧化碳反应能生成金刚石(C)和碳酸钠,该反应的化学方程式为 。
(5)将吸入的石油挤出后仍可恢复原是已知最轻的固体材料(如下图所示),由碳元素组成,具有多孔结构,
弹性好。它对石油有很强的吸附能力(不吸水),将吸入的石油挤出后仍可恢复原状。下列关于碳海绵的说法正确的是 (填字母序号)。

A.具有吸附性
B.可重复使用
C.可处理海上石油泄漏
27.人类维持生命和健康必须摄取食物。
(1)下列食物富含糖类的是____ (填字母序号)。

(2)饼干中常添加碳酸钙,其作用是_______ 。
(3)化肥对提高粮食产量具有重要的作用。[CO(NH2)2]是一种常用的化肥,工业上生产尿素的反应的微观示意图如下:

①尿素由_______ 种元素组成,属于________ (填“氮”、“磷”或“钾”)肥。
②生产尿素的反应中,A与 B的质量比为_______ 。
(1)下列食物富含糖类的是

(2)饼干中常添加碳酸钙,其作用是
(3)化肥对提高粮食产量具有重要的作用。[CO(NH2)2]是一种常用的化肥,工业上生产尿素的反应的微观示意图如下:

①尿素由
②生产尿素的反应中,A与 B的质量比为
28.水是最普通、最常见的物质之一。
(1)“水”有很多种。下列“水”属于纯净物的是________ (填字母序号)。
(2)电解水可证明水由氢、氧两种元素组成,该反应的化学方程式为_______ 。
(3)水是重要的溶剂和化工原料。氯碱工业以饱和食盐水为原料获得烧碱等化工产品,反应原理为: 2NaCl+2H2O 2NaOH+H2。
2NaOH+H2。
①20℃时,NaCl 的溶解度是36 g。该温度下,饱和食盐水中溶质与溶剂的质量比为_______ 。
②烧碱可用于处理硫酸泄漏,反应的化学方程式为________ 。
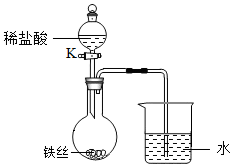
(4)水在化学实验中具有重要作用。将铁丝放在潮湿的空气中(如图所示),一段时间后,观察到导管内液面下降,导管口有气泡冒出,关闭 K。请解释导管内液面上升和下降的原因:________________ 。
(1)“水”有很多种。下列“水”属于纯净物的是
| A.河水 | B.自来水 | C.矿泉水 | D.蒸馏水 |
(3)水是重要的溶剂和化工原料。氯碱工业以饱和食盐水为原料获得烧碱等化工产品,反应原理为: 2NaCl+2H2O
 2NaOH+H2。
2NaOH+H2。①20℃时,NaCl 的溶解度是36 g。该温度下,饱和食盐水中溶质与溶剂的质量比为
②烧碱可用于处理硫酸泄漏,反应的化学方程式为
(4)水在化学实验中具有重要作用。将铁丝放在潮湿的空气中(如图所示),一段时间后,观察到导管内液面下降,导管口有气泡冒出,关闭 K。请解释导管内液面上升和下降的原因:

29.铜是人类最早利用的金属之一。
(1)下列铜制品中,利用金属导热性的是________ (填字母序号)。

A.铜质奖牌 B.铜导线 C.铜火锅
(2)“湿法炼铜”的原理是硫酸铜溶液与铁反应,该反应的化学方程式为________ 。
(3)利用废旧电池铜帽(含 Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如下(反应条件已略去):

已知:2Cu+2H2SO4+O2 2CuSO4+2H2O
2CuSO4+2H2O
①过程Ⅱ中分离操作的名称是________ 。
②过程Ⅲ中有气体产生,反应的化学方程式为________ 。
③A~E 中含铜、锌两种元素的物质有________ (填字母序号)。
(1)下列铜制品中,利用金属导热性的是

A.铜质奖牌 B.铜导线 C.铜火锅
(2)“湿法炼铜”的原理是硫酸铜溶液与铁反应,该反应的化学方程式为
(3)利用废旧电池铜帽(含 Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如下(反应条件已略去):

已知:2Cu+2H2SO4+O2
 2CuSO4+2H2O
2CuSO4+2H2O ①过程Ⅱ中分离操作的名称是
②过程Ⅲ中有气体产生,反应的化学方程式为
③A~E 中含铜、锌两种元素的物质有
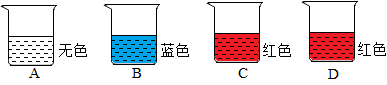
30.现有四只烧杯,分别盛有稀盐酸、饱和石灰水、碳酸钠溶液中的一种,并向其中滴加了酚酞或石蕊溶液(如下图所示)。
已知:碳酸钠溶液呈碱性,氯化钙溶液呈中性。
选用下列药品继续实验:铁、氧化钙、氧化铁、稀盐酸、饱和石灰水、碳酸钠溶液请依据实验回答问题:
(1)B 中溶液是________ 。
(2)取A 中溶液于试管中,加入甲,溶液由无色变为黄色,则甲是_______ ,反应的化学方程式为_______ 。
(3)取C中溶液于试管中,加入乙,溶液变浑浊;再加入丙,又变澄清,且由红色变为无色,无气泡产生,则乙的化学式为_______ 。
(4)取D中溶液于试管中,加入丁,溶液变浑浊;再加入丙,又变澄清,且由红色变为无色,同时产生气泡。
①用化学方程式表示溶液变浑浊的原因:_______ 。
②最终所得溶液中溶质的组成为______________________________ (写出所有可能)。
已知:碳酸钠溶液呈碱性,氯化钙溶液呈中性。

选用下列药品继续实验:铁、氧化钙、氧化铁、稀盐酸、饱和石灰水、碳酸钠溶液请依据实验回答问题:
(1)B 中溶液是
(2)取A 中溶液于试管中,加入甲,溶液由无色变为黄色,则甲是
(3)取C中溶液于试管中,加入乙,溶液变浑浊;再加入丙,又变澄清,且由红色变为无色,无气泡产生,则乙的化学式为
(4)取D中溶液于试管中,加入丁,溶液变浑浊;再加入丙,又变澄清,且由红色变为无色,同时产生气泡。
①用化学方程式表示溶液变浑浊的原因:
②最终所得溶液中溶质的组成为
31.根据下图回答问题。
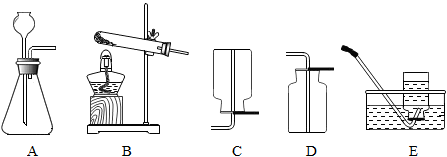
(1)仪器a的名称是________ 。
(2)实验室用高锰酸钾制取氧气的化学方程式为________ ,选用的发生装置是_______ (填字母序号,下同)。
(3)实验室制取二氧化碳时,选用的收集装置是_______ 。将燃着的木条放在瓶口,若观察到_______ ,说明瓶中已充满二氧化碳。向该集气瓶中加入紫色石蕊溶液,振荡后,观察到溶液变红,发生反应的化学方程式为________ 。

(1)仪器a的名称是
(2)实验室用高锰酸钾制取氧气的化学方程式为
(3)实验室制取二氧化碳时,选用的收集装置是
32.化学小组的同学探究二氧化碳氢氧化钠的反应,实验方案如下:
(1)步骤①中气球鼓起的原因可能是___________ 。
(2)步骤②中的操作是________ ,其目的是__________ 。
(3)步骤④中发生反应的化学方程式为_____________ 。
(4)本实验的结论是_____________ 。
实验装置 | 实验步骤及操作 | 实验现象 |
| ①将注射器1中的溶液推入充有CO2的瓶中 | 气球鼓起 |
②… | 无明显现象 | |
③将注射器2中的溶液推入瓶中 | 溶液中有气泡产生,气球变瘪 | |
④向外拉注射器3 | 澄清石灰水变浑浊 |
(2)步骤②中的操作是
(3)步骤④中发生反应的化学方程式为
(4)本实验的结论是
33.四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数,反应原理为:2Na2S4+O2+2H2O=8S↓+4NaOH。
(实验资料)
①受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢(水溶液呈酸性)。
②硫代硫酸钠(Na2S2O3)可溶于水,常温下与溶液不反应。
(实验过程)
①碳酸钠、硫粉混合后置于试管中,加热(如图1所示,夹持装置已略去),制得 Na2S4,反应4Na2CO3+12S+X 2Na2S4+2Na2S2O3+4CO2,X 的化学式为
2Na2S4+2Na2S2O3+4CO2,X 的化学式为___________ ,蘸有浓NaOH 溶液的棉花的作用是________________ 。
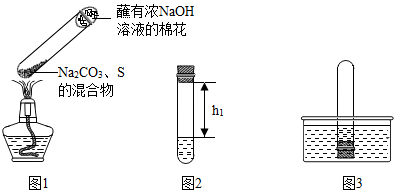
②冷却后,取下棉花,入置一段时间,再向该试管中加入10ml水,迅速塞紧橡胶塞,充分振荡,测量液面至橡胶塞下沿的距离,记录数据h1(如图2所示)
③将该试管插入水中(如图3所求),按下橡胶塞,观察到_____ ,塞紧橡胶塞。将试管取出,倒过来,测量液面至橡胶塞下沿的距离,记录数据h2,理论上h1:h2=____
④按照①——③再重复实验2次。3次实验数据如下表所示。
(解释与结论)根据第1次实验数据,计划空气中氧气的体积分数为____ %(结果精确到0.1%)
(反应与评价)若实验过程②中,取下棉花后,未放置一段时间即进行后续操作,会影响测定结果,请说明有何影响,并阐述理由:______ 。
(实验资料)
①受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢(水溶液呈酸性)。
②硫代硫酸钠(Na2S2O3)可溶于水,常温下与溶液不反应。
(实验过程)
①碳酸钠、硫粉混合后置于试管中,加热(如图1所示,夹持装置已略去),制得 Na2S4,反应4Na2CO3+12S+X
 2Na2S4+2Na2S2O3+4CO2,X 的化学式为
2Na2S4+2Na2S2O3+4CO2,X 的化学式为
②冷却后,取下棉花,入置一段时间,再向该试管中加入10ml水,迅速塞紧橡胶塞,充分振荡,测量液面至橡胶塞下沿的距离,记录数据h1(如图2所示)
③将该试管插入水中(如图3所求),按下橡胶塞,观察到
④按照①——③再重复实验2次。3次实验数据如下表所示。
| | 第1次 | 第2次 | 第3次 |
| h1/cm | 11.0 | 11.4 | 11.6 |
| h2/cm | 8.7 | 9.1 | 9.2 |
(反应与评价)若实验过程②中,取下棉花后,未放置一段时间即进行后续操作,会影响测定结果,请说明有何影响,并阐述理由:
34.甲醇(CH2OH)是基础化工原料,制备原理为:CO+2H2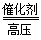 CH3OH当消耗5.6kgCO时,计算生成甲醇的质量。
CH3OH当消耗5.6kgCO时,计算生成甲醇的质量。
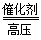 CH3OH当消耗5.6kgCO时,计算生成甲醇的质量。
CH3OH当消耗5.6kgCO时,计算生成甲醇的质量。35.氧化亚铜(Cu2O)可用于船底防污漆,防止海生物对船舶设备的污损,现将Cu2O和Cu的固体混合物6.8kg放入烧杯中,加入过量的质量分数为20%的稀硫酸30g,充分反应后,过滤、洗涤、干燥,得到4.8g固体。
已知:Cu2O+H2SO4=CuSO4+Cu+H2O
计算:(1)所加稀硫酸中溶质的质量为____g.
(2)原混合物中的Cu2O和Cu质量比(写出过程,结果用最简整数比表示)。
已知:Cu2O+H2SO4=CuSO4+Cu+H2O
计算:(1)所加稀硫酸中溶质的质量为____g.
(2)原混合物中的Cu2O和Cu质量比(写出过程,结果用最简整数比表示)。
 搜索
搜索
 难度系数:0.94
难度系数:0.94  答案解析
答案解析
 有奖纠错
有奖纠错

