全一卷
1.下列过程中,只发生物理变化的是
| A.铁钉生锈 | B.蜡烛燃烧 | C.矿石粉碎 | D.青稞酿酒 |
2.下列属于有机合成材料的是
| A.大理石 | B.塑料 | C.羊毛 | D.棉花 |
3.市场上有“含铁酱油”、“高钙牛奶”等商品,这里的“铁、钙”指的是
| A.元素 | B.原子 | C.单质 | D.分子 |
4.下列厨房里的物质与水混合充分搅拌后,不能形成溶液的是
| A.味精 | B.蔗糖 | C.食盐 | D.菜籽油 |
5.下列物质中属于纯净物的是
| A.生铁 | B.清洁的空气 | C.水泥砂浆 | D.冰水混合物物 |
6.下列熟悉的小吃中,维生素含量较高的是
| A.酸奶 | B.胡萝ト包子 | C.手抓羊肉 | D.酿皮 |
7.规范实验操作是获得实验成功的重要保证。下列化学实验操作正确的是
A. 读出液体的体积 读出液体的体积 | B. 过滤 过滤 | C. 熄灭酒精灯 熄灭酒精灯 | D. 稀释浓硫酸 稀释浓硫酸 |
8.对下列物质的俗称,理解错误的是
| A.干冰不是冰 | B.纯碱不是碱 | C.醋酸不是酸 | D.水银不是银 |
9.现有反应:2Cu(NO3)2 2CuO+O2↑+4X↑,则X 的化学式为
2CuO+O2↑+4X↑,则X 的化学式为
 2CuO+O2↑+4X↑,则X 的化学式为
2CuO+O2↑+4X↑,则X 的化学式为| A.NO | B.NO2 |
| C.NH3 | D.N2O3 |
10.归纳与反思是学习化学的重要环节。下列归纳正确的是
| A.NaOH有吸水性一做食品干燥剂 | B.铵态氮肥和熟石灰混用一提高肥效 |
| C.干冰升华吸热——用于人工降雨 | D.缺碘——易引起贫血 |
11.青海盛产高原野生菌,有的口味鲜美、营养丰富,有的含有一种麦角甾醇类毒素(C29H460),不能食用。关于该毒素说法正确的是
| A.由三种元素组成 | B.碳、氢元素的质量比是29:46 |
| C.属于氧化物 | D.相对分子质量为410g |
12.如图所示实验设计不能达到目的是
A. 验证化学反应前后质量守恒 验证化学反应前后质量守恒 | B. 鉴别碳酸钠溶液和氢氧化钠溶液 鉴别碳酸钠溶液和氢氧化钠溶液 |
C. 测定空气中的氧气含量 测定空气中的氧气含量 | D. 证明分子在不断地运动 证明分子在不断地运动 |
13.除去下列物质中的杂质,所选试剂及操作方法错误的是
| 选项 | 物质(括号内为杂质) | 选用试剂及操作方法 |
| A | CO2(CO) | 通过足量的灼热氧化铜 |
| B | Cu粉(Fe粉) | 加过量的稀盐酸,过滤 |
| C | FeCl2溶液(CuCL2) | 加过量铁粉,过滤 |
| D | Ca0粉末(CaCO3粉末) | 加足量的水,充分搅拌后过滤 |
| A.A | B.B | C.C | D.D |
14.用化学用语填空:3个铵根离子_________;标出N205中氮元素的化合价_______
15.元素周期表是学习和研究化学的重要工具。溴元素的相关信息如图1所示,回答下列问题
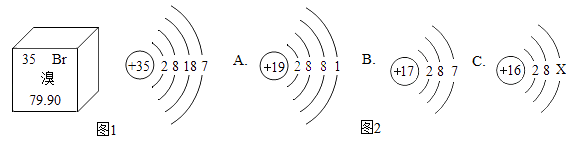
(1)溴的相对原子质量是__________ 。
(2)溴元素的化学性质与图2哪种元素的化学性质相似______________ (填序号)。
(3)若图2中C表示原子的结构,则X=___________________ 。

(1)溴的相对原子质量是
(2)溴元素的化学性质与图2哪种元素的化学性质相似
(3)若图2中C表示原子的结构,则X=
16.2018年3月5日,李克强总理在政府报告中指出:“坚持人与自然和谐发展,着力治理环境污染,树立绿水青山就是金山银山理念。优化能源结构,煤炭消费比重下降8.1个百分点,清洁能源消费比重提高6.3个百分点”。让我们从化学的视角领悟报告精神。
(1)水是重要的自然资源,下列做法有利于保护水资源的是(______)
(2)煤燃烧时产生的___________(填化学式)和二氧化氮等气体是造成酸雨的主要原因。
(3)天然气是生活中常用的较清洁燃料,写出其燃烧的化学反应方程式________。
(1)水是重要的自然资源,下列做法有利于保护水资源的是(______)
| A.大量使用化肥农药 | B.生活污水直接排放 |
| C.畜牧场污水直接排放 | D.工业废水处理达标后排放 |
(3)天然气是生活中常用的较清洁燃料,写出其燃烧的化学反应方程式________。
17.a、b、c三种固体物质的溶解度曲线如图所示:
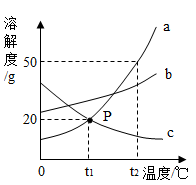
(1)P点表示___________________________________ 。
(2)将接近饱和的c溶液变为饱和溶液,可采用____________ 的方法(写出一种)。
(3)t2℃时,将30g的a物质加入到50g水中充分搅拌,所得溶液质量为___________ g。

(1)P点表示
(2)将接近饱和的c溶液变为饱和溶液,可采用
(3)t2℃时,将30g的a物质加入到50g水中充分搅拌,所得溶液质量为
18.下图形象地表示了在加热、催化剂条件下,某化学反应前后反应物与生成物分子及其数目的变化,其中  表示硫原子,
表示硫原子,  表示氧原子:
表示氧原子:
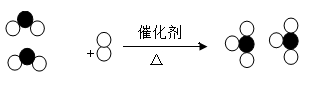
写出该反应的化学方程式_________________________ ,其基本反应类型为_________________ 。
 表示硫原子,
表示硫原子,  表示氧原子:
表示氧原子:
写出该反应的化学方程式
19.下图中A、B、C、D是四种常见的物质。其中,A是胃酸的主要成分,B为最轻的气体,C属于盐类,是用小苏打治疗胃酸过多症时发生反应的生成物之一,D的溶液呈黄色。

(1)C物质的化学式是__________。
(2)写出符合下列转化的化学反应方程式:
A→B:____________________________(只写一个)
A→D:_______________________________________。

(1)C物质的化学式是__________。
(2)写出符合下列转化的化学反应方程式:
A→B:____________________________(只写一个)
A→D:_______________________________________。
20.下图是实验室制取气体并验证气体性质的装置:
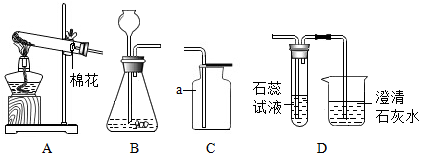
(1)若将装置A和C相连接制取氧气,写出反应的化学方程式________________ ;检验氧气收集满的方法是_____________________ 。
(2)若将装置B和D相连接用于制取二氧化碳气体并验证其化学性质,写出装置B中发生反应的化学方程式______________________________________ ;可观察到试管中石蕊溶液____________ ;写出烧杯中二氧化碳与澄清石灰水反应的化学方程式__________________________ 。

(1)若将装置A和C相连接制取氧气,写出反应的化学方程式
(2)若将装置B和D相连接用于制取二氧化碳气体并验证其化学性质,写出装置B中发生反应的化学方程式
21.学习合金知识后,知道了不锈钢中含有金属铬。某同学想:铬与常见铁、铜相比,其金属活动性强弱如何呢?于是,和同学们一起进行了以下探究。
【查阅资料】①铬是银白色有光泽的金属,在空气中,像铝一样,其表面能产生致密的氧化膜:②能与稀硫酸反应,生成硫酸亚铬(CrSO4)。
【知识回顾】金属活动性顺序: K Ca Na Mg Al Zn_______ Sn Pb(H)_______ Hg Ag Pt Au(在横线上填写对应金属的元素符号)
【作出猜想】猜想①Cr>Fe>Cu;猜想②Fe>Cu>Cr;猜想③__________________ 。
【设计与实验】①张明同学取大小相等的铁、铜、铬三种金属片,未经打磨就分别放入等量等浓度的稀硫酸中,记录如下:
②李红同学也取大小相等的铁、铜、铬三种金属片,先用砂纸打磨后再分别放入等量等浓度的稀硫酸中,记录如下:
【讨论交流】为什么张明和李红两个同学记录的铬与稀硫酸反应开始的现象截然不同?
原因是__________________________________________________ 。
【实验验证】为了进一步确认铁、铜、铬三种金属的活动性强弱,刘斌同学将打磨过的两块铁片分别放入硫酸亚铬(CrSO4)溶液和硫酸铜溶液中,观察到在硫酸亚铬溶液中无明显现象,而在硫酸铜溶液中有明显的现象是__________________________________________ ,其反应的化学方程式是__________________________________________________ 。
【拓展迁移】写出铬与稀硫酸反应,生成CrSO4的化学反应方程式____________________ 。
【查阅资料】①铬是银白色有光泽的金属,在空气中,像铝一样,其表面能产生致密的氧化膜:②能与稀硫酸反应,生成硫酸亚铬(CrSO4)。
【知识回顾】金属活动性顺序: K Ca Na Mg Al Zn
【作出猜想】猜想①Cr>Fe>Cu;猜想②Fe>Cu>Cr;猜想③
【设计与实验】①张明同学取大小相等的铁、铜、铬三种金属片,未经打磨就分别放入等量等浓度的稀硫酸中,记录如下:
| t度实验操作 | 铁片放在稀硫酸酸中 | 铜片放在稀硫酸中 | 铬片放在稀硫酸中 |
| 开始的现象 | 有少量气泡产生 | 无气泡 | 无气泡 |
| 结论 | 金属活动性强弱:Fe>Cu,Fe>Cr | ||
②李红同学也取大小相等的铁、铜、铬三种金属片,先用砂纸打磨后再分别放入等量等浓度的稀硫酸中,记录如下:
| 实验操作 | 铁片放在稀硫酸中 | 铜片放在稀硫酸中 | 铬片放在稀硫酸中 |
| 开始的现象 | 产生少量气泡 | 无气泡 | 产生大量气泡 |
| 结论 | 金属活动性强弱: | ||
【讨论交流】为什么张明和李红两个同学记录的铬与稀硫酸反应开始的现象截然不同?
原因是
【实验验证】为了进一步确认铁、铜、铬三种金属的活动性强弱,刘斌同学将打磨过的两块铁片分别放入硫酸亚铬(CrSO4)溶液和硫酸铜溶液中,观察到在硫酸亚铬溶液中无明显现象,而在硫酸铜溶液中有明显的现象是
【拓展迁移】写出铬与稀硫酸反应,生成CrSO4的化学反应方程式
22.某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液68.0g,加入二氧化锰2.0g,待完全反应不再有气体逸出时,称得得剩余物质的总质量为68.4g。计算:
(1)反应完全后产生氧气的质量是__________g。
(2)该过氧化氢溶液中溶质的质量分数(写出计算过程)___________
(1)反应完全后产生氧气的质量是__________g。
(2)该过氧化氢溶液中溶质的质量分数(写出计算过程)___________
 搜索
搜索
 难度系数:0.85
难度系数:0.85  答案解析
答案解析
 有奖纠错
有奖纠错
